题目内容
8.如表各图是化学反应原理模块中的实验装置,请将符合图示的下列选项的字母填入相应表格中. |  | 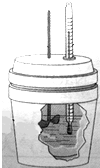 |  |
C.酸碱中和滴定 D.精确测量溶液pH的酸度计.
分析  中有滴定管,为中和滴定实验;
中有滴定管,为中和滴定实验; 可测定pH;
可测定pH; 中有温度计、搅拌棒、保温桶,可测得中和热;
中有温度计、搅拌棒、保温桶,可测得中和热; 可测得气体的体积,测定反应速率,以此来解答.
可测得气体的体积,测定反应速率,以此来解答.
解答 解: 中有滴定管,为酸碱中和滴定实验,选C;
中有滴定管,为酸碱中和滴定实验,选C; 可精确测量溶液pH的酸度计,选D;
可精确测量溶液pH的酸度计,选D; 中有温度计、搅拌棒、保温桶,可测定反应热的简易装置,选A;
中有温度计、搅拌棒、保温桶,可测定反应热的简易装置,选A; 可量气法测定化学反应速率,选B,
可量气法测定化学反应速率,选B,
故答案为:C;D;A;B.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的使用、实验装置的作用、定量实验为解答的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.X、Y是元素周期表VIIA族中的两种元素.下列叙述中能说明X的原子得电子能力比Y强的是( )
| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | X的氢化物的水溶液酸性比Y的氢化物的水溶液酸性强 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
3.新能源又称非常规能源.是指传统能源之外的各种能源形式.下列能源中不属于新能源的是( )
| A. | 风能 | B. | 煤 | C. | 太阳能 | D. | 生物质能 |
17.利用工厂废弃的合金制得氯化铝固体、硝酸铜晶体和铁红的生产流程如图,下列叙述错误的是( )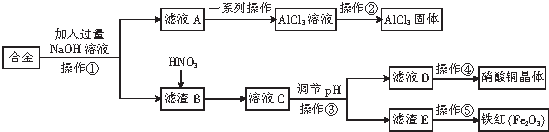

| A. | 滤液A中的溶质主要是NaAlO2和NaOH | |
| B. | 调pH时,可以加入CuO或Cu2(OH)2CO3 | |
| C. | 操作②是在蒸发皿中直接蒸干水分 | |
| D. | 该合金中含有的金属主要为铁、铜、铝 |
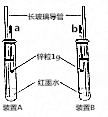 某化学兴趣小组按图示装好了实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸.实验时同时完全捏扁a、b的胶头,观察实验现象.
某化学兴趣小组按图示装好了实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸.实验时同时完全捏扁a、b的胶头,观察实验现象. Na2O2可用作漂白剂和呼吸面具中的供氧剂.
Na2O2可用作漂白剂和呼吸面具中的供氧剂.