题目内容
|
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)
| |
A. |
点a的正反应速率比点b的大 |
B. |
点c处反应达到平衡 |
C. |
点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
D. |
其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大 |
答案:AD
解析:
提示:
解析:
|
本题是图象分析题,应特别注意c点是氨气和氢气的浓度相等点,但绝非平衡点,总反应速率等于正反应速率和逆反应速率的代数和,反应物浓度从一开始在不断降低,因此正反应速率在其他条件不变的情况下在降低,因此A的分析是正确的,平衡点就是浓度曲线水平的点,因此B是错误的,从d点往后的点,均是平衡状态,所以其氮气的浓度相同,根据勒沙特乐原理,升温平衡将逆向移动,因此D是正确的. |
提示:
|
本题综合考查了速率、平衡以及图象问题,命题巧妙,值得推敲. |

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目

 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应: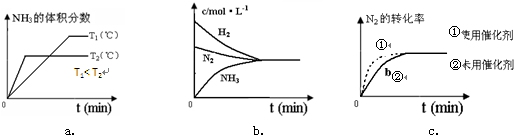
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)  2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示.下列叙述中,正确的是( )
2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示.下列叙述中,正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)