题目内容
10.下列对化学实验的描述正确的是( )| A. | 向容量瓶或分液漏斗中注入溶液时,应该将两者口部的玻璃塞倒置在桌面上 | |
| B. | 在实验室做蒸馏实验的装置中用到两个铁架台、三个单孔胶塞 | |
| C. | 将等体积不同浓度的酸性高锰酸钾分别滴入等浓度体积的草酸溶液中,依据褪色快慢,比较浓度对翻译速率的影响 | |
| D. | 过量的浓硫酸与铜屑共热,能得到澄清透明的蓝色溶液 |
分析 A.容量瓶或分液漏斗的玻璃塞是一一对应的;
B.根据蒸馏实验的装置中,通过铁架台固定蒸馏烧瓶和冷凝管,温度计固定于单孔胶塞用来测量蒸汽的温度,冷凝管的两端分别用单孔胶塞连接烧瓶和牛角管;
C.应用等体积不同浓度的酸性高锰酸钾与等浓度体积的草酸溶液反应;
D.浓硫酸中水很少.
解答 解:A.容量瓶或分液漏斗的玻璃塞是一一对应的,应用绳子拴住,故A错误;
B.在做蒸馏实验时用到铁架台有2处:固定蒸馏烧瓶和冷凝管,单孔胶塞分别用于固定温度计、连接冷凝管的两端,共3处,故B正确;
C.应用等体积不同浓度的酸性高锰酸钾与等浓度体积的草酸溶液反应,通过测量褪色的时间长短来研究浓度对反应速率的影响,故C错误;
D.浓硫酸中水很少,得不到蓝色溶液,为白色沉淀,故D错误.
故选B.
点评 本题考查化学实验方案评价,涉及实验基本操作等知识点,明确实验原理是解本题关键,会根据实验现象、物质性质分析解答,题目难度中等.

练习册系列答案
相关题目
1.在一定温度下的恒容密闭容器中,能说明化学反应X2(g)+Y2(g)?2XY(g)已达到平衡状态的是( )
| A. | 容器内的总压强不随时间变化 | B. | 正、逆反应都还在继续进行 | ||
| C. | XY气体的物质的量分数不变 | D. | X2和Y2的消耗速率相等 |
18.将11g铝、铁混合物投人280mL 4mol•L-1的稀硝酸中,金属完全溶解,生成0.28mol气体,向反应后的溶液中加人500mL3mol•L-1的Na0H溶液,并充分搅拌、过滤、洗涤、干燥后称量得到10.7g固体.下列说法正确的是( )
| A. | 混合物中铝、铁的物质的量之比1:2 | |
| B. | 混合物与稀硝酸反应后的溶液还能溶解1.28g Cu | |
| C. | 将0.28mol气体通人水中并完全被吸收时,需要消耗0.14mol氧气 | |
| D. | 10.7g固体为Al(OH)3和Fe(OH)3的混合物 |
5.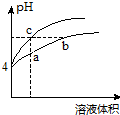 某温度下,体积和pH都相同的氯化铵溶液和盐酸加水稀释时的pH变化曲线如图所示.下列判断正确的是( )
某温度下,体积和pH都相同的氯化铵溶液和盐酸加水稀释时的pH变化曲线如图所示.下列判断正确的是( )
 某温度下,体积和pH都相同的氯化铵溶液和盐酸加水稀释时的pH变化曲线如图所示.下列判断正确的是( )
某温度下,体积和pH都相同的氯化铵溶液和盐酸加水稀释时的pH变化曲线如图所示.下列判断正确的是( )| A. | a、c两点溶液的导电能力:c>a | |
| B. | a、b、c三点溶液中水的电离程度:a>b>c | |
| C. | b点溶液中:c(H+)=c(Cl-)+c(OH-) | |
| D. | 用NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb=Vc |
2.下列有关Si、Cl、N、S等非金属元素化合物的说法正确的是( )
| A. | 过量的铁粉与氯气反应生成FeCl2 | |
| B. | 少量SO2通入Ca(ClO)2 溶液生成CaSO3沉淀 | |
| C. | 常温下,1 mol Fe与足量浓硝酸反应,转移2NA个电子 | |
| D. | 硅酸钠的水溶液是制备硅胶和木材防火剂的原料 |
20.根据下列实验操作及现象,所得结论正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向10mL 1mol/LNaOH溶液中先加入3滴1mol/LMgCl2溶液,再加入3滴1mol/LFeCl3溶液 | 现有白色沉淀,后为红褐色沉淀 | Mg(OH)2转化为Fe(OH)3 |
| B | 向某氯化亚铁溶液中,加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 有白色沉淀生成 | 溶液X中一定含有CO32-或HCO3- |
| D | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液 | 前者为黄色沉淀,后者为红褐色液体 | 温度升高,Fe3+的水解程度增大 |
| A. | A | B. | B | C. | C | D. | D |
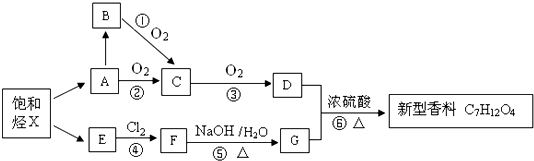
 ,以下是有机玻璃的一种合成路线:
,以下是有机玻璃的一种合成路线:
 ,A生成B的反应类型是加成反应.
,A生成B的反应类型是加成反应. .
. 的同分异构体中符合下列条件的有10种(不考虑立体异构);
的同分异构体中符合下列条件的有10种(不考虑立体异构); (填结构简式).
(填结构简式). 的合成路线:
的合成路线: $→_{Cu/△}^{O_{2}}$
$→_{Cu/△}^{O_{2}}$ $→_{一定条件}^{HCN}$
$→_{一定条件}^{HCN}$ $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$ $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ .
.
 .
.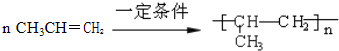 .
. 某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去).图中K为止水夹(处于关闭状态),F是一半空的注射器.
某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去).图中K为止水夹(处于关闭状态),F是一半空的注射器.