题目内容
下列实验操作都能达到预期目的的是( )
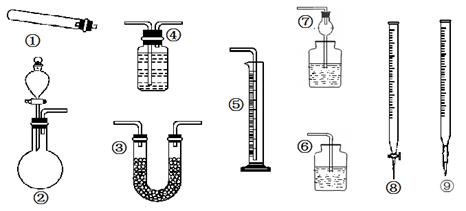
①蒸干AlCl3溶液可得纯净的无水氯化铝;②纸层析法分离铁离子和铜离子实验中,点样后的滤纸需晾干后,才能将滤纸下端浸入展开剂中进行实验;③用广泛pH试纸测得某溶液pH为3.5;④滴入酚酞溶液确定纯碱中有无烧碱;⑤用米汤直接检验食用盐中是否含有碘元素;⑥用酸式滴定管量取20.00 mL高锰酸钾酸性溶液;⑦用溴的四氯化碳溶液除去混在甲烷中的乙烯气体
| A.⑥⑦ | B.②⑥ | C.⑤⑥⑦ | D.只有⑥ |
B
解析试题分析:①蒸干AlCl3溶液应该得Al(OH)3固体(因加热导致AlCl3的水解产物之一HCl大量挥发,促进AlCl3的水解),该项错误;③用广泛pH试纸测得溶液pH值应该为整数,该项错误;④向纯碱中滴入酚酞溶液只能确定其溶液是否显碱性,但不能确定是否含有烧碱,该项错误;⑤食用盐中添加的是KIO3,与淀粉(米汤)不发生显色反应,该项错误;⑦甲烷能溶于四氯化碳,但不能达到除杂的目的,该项错误。
考点:化学实验的基本操作。本题分别考查了盐溶液的蒸干,铁、铜离子的纸层析分离法,溶液的pH测定,碱性溶液的检验,淀粉遇碘单质变蓝,酸式滴定管的使用,有机物的除杂等知识。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案下列叙述正确的是( )
①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊既可用于收集H2、CO2、Cl2和HCl气体,也可用于干燥H2、CO2、Cl2和HCl气体。
| A.①⑤ | B.④⑤ | C.①② | D.③⑤ |
(15分)
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
NaBr+H2SO4 HBr+NaHSO4
HBr+NaHSO4
CH3CH2OH+HBr CH3CH2Br+H2O
CH3CH2Br+H2O
化学兴趣小组根据实验原理设计如右图的装置。
根据题意完成下列填空:有关数据列表如下:
| | 乙醇 | 溴乙烷 |
| 状态 | 无色液体 | 无色液体 |
| 密度/g · cm-3 | 0.8 | 1.4 |
| 沸点/℃ | 78.5 | 119.0 |
| 熔点/℃ | -l30 | 38.4 |
(1)圆底烧瓶中加入的反应物是溴化钠、 和2:1的硫酸。配制体积比2:1的硫酸所用的仪器为 (选填编号)
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶 e.滴定管
(2)将生成物导入盛有冰水混合物的试管A中,试管A中的物质分为三层(如图所示),产物在第
层;
(3)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质应加
入 (选填编号)然后再进行 一步操作即可;
a.无水氯化钙 b.硝酸银溶液 c.四氯化碳 d.亚硫酸钠溶液
(4)实验过程中,同学发现仪器连接部分有漏气现象,老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是: ;
(5)假设最初取用的无水乙醇是57.5mL,最后得到的纯净的溴乙烷是52.0mL,则溴乙烷的产率为 。
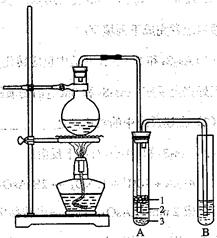
(12分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如下:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
V.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是______________________。
(2)棉花中浸润的溶液为__________________。
(3)A中发生反应的化学方程式为__________________________________。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________
(5)过程Ⅵ中检验B溶液中是否含有硫酸根的操作是________________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是
| | 过程IV B溶液中含有的离子 | 过程VI B溶液中含有的离子 |
| 甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
实验需要0.1 mol/L NaOH溶液450 mL,根据溶液配制中的情况回答下列问题:
(1)实验中除了托盘天平、烧杯、容量瓶外还需要的其他仪器有___ ___
_______________________________________________ __________。
(2)根据计算得知,所需NaOH的质量为________g。
(3)配制一定物质的量浓度溶液的实验中,如果出现以下操作
| A.称量时用了生锈的砝码 |
| B.将NaOH放在纸张上称量 |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 |
| D.往容量瓶转移时,有少量液体溅出 |
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
对配制的溶液物质的量浓度大小可能造成的影响是(填写字母)偏大的有________。