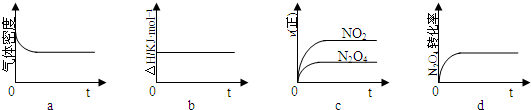题目内容
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (Ⅰ)+2N2O4 (Ⅰ)=2CO2 (g)+3N2(g)+4H2O(g)(Ⅰ)![]()
(1) 反应(Ⅰ)中氧化剂是_______.
(2) 火箭残骸中常现红棕色气体,原因为:N2O4 (g) ![]() 2NO2 (g) (Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
2NO2 (g) (Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
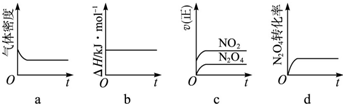
(3) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________ .

若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·S-1。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____ (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填”正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______ mol·L-1。(NH3·H2O的电离平衡常数取Kb=2X10-5 mol·L-1)
(1)N2O4 (2)吸热
(3) a,d;不变;0.1 (4) NH4++H2O![]() NH3H2O+H+;逆向
NH3H2O+H+;逆向
a/200b

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目