题目内容
①最常见的溶剂是
③能产生温室效应的气体是
(2)标准状况下11.2LHCl气体的物质的量是
(3)在V L Al2(SO4)3溶液中,测得含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为
(4)在标准状况下,2molCO2的体积为
(5)有些膨化食品包装袋中有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO).
①生石灰按无机物分类属于
②生石灰可做干燥剂的理由是
③小纸袋中的生石灰能否长期持续地做干燥剂?
(2)根据物质的量与气体体积的关系求解气体的物质的量,根据物质的量与物质的量浓度的关系求解物质的量浓度;
(3)根据分子中某元素物质的量与质量的关系求解物质的量,进而求该分子的物质的量,已知体积可求得分子的物质的量浓度,也可以求该分子中其他离子的物质的量浓度;
(4)根据物质的量与气体的体积和质量的关系求解气体的体积和质量;
(5)根据物质的分类,物质可以分为单质和化合物,其中化合物又分为氧化物、酸、碱、盐,其中氧化钙属于氧化物,考查化学方程式的书写,氧化钙做干燥剂的实质及失效等来解题.
(2)n=
| V |
| Vm |
| 11.2 L |
| 22.4 L/mol |
| n |
| V |
| 0.5 mol |
| 1 L |
(3)n(Al3+)=
| m |
| M |
| a g |
| 27 g/mol |
| n(Al3+) |
| 2 |
| a mol |
| 54 |
| n |
| V |
| a mol |
| 54 |
故答案为:a/54Vmol?L-1;a/18V mol?L-1;
(4)V=Vm×n=22.4 L/mol×2 mol=44.8 L; m=n×M=2 mol×44 g/mol=88g,故答案为:44.8;88;
(5)①物质分为单质和化合物,其中化合物又可分为氧化物、酸、碱和盐,根据氧化钙的特征可知氧化钙为氧物,故答案为:氧化物;
②氧化钙具有吸水性,利用其吸水性,可以用来做干燥剂,故此空为能吸水;氧化钙吸水的化学方程式为
CaO+H2O=Ca(OH)2,故答案为:能吸水;CaO+H2O=Ca(OH)2;
③氧化钙在空气中会结合水生成氢氧化钙,氢氧化钙又会结合空气中的二氧化碳生成碳酸钙沉淀,故氧化钙不能长期持续使用故此空为不能,原因为氧化钙与水反应生成氢氧化钙,氢氧化钙又与空气中二氧化碳反应生成碳酸钙,故答案为:不能;氧化钙与水反应生成氢氧化钙,氢氧化钙又与空气中二氧化碳反应生成碳酸钙.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案在1×105Pa和298K时,将拆开1mol共价键所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:
|
共价键 |
H-H |
N≡N |
N-H |
|
键能(kJ·mol-1) |
436 |
945 |
391 |
(1)根据上表中的数据判断工业合成氨的反应:N2+3H2 2NH3是___________(填“吸热”或“放热”)反应;
2NH3是___________(填“吸热”或“放热”)反应;
(2)在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反应,若氮气和氢气完全反应,理论上放出或吸收的热量为Q1,则Q1为__________;
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是 ( )
A. Q1>Q2 B. Q1<Q2 C. Q1=Q2
如此选择的理由_________________________________________________;
⑷.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充人1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2 2NH3。下列有关说法正确的是_______________________.
2NH3。下列有关说法正确的是_______________________.
A.达到化学平衡时,正反应和逆反应的速率都为零。
B.当符合:3u正(N2)=u正(H2)时,反应达到平衡状态。
C.达到化学平衡时,单位时间消耗amolN2,同时生成3amolH2
D.反应达到平衡状态,最多可生成氨2 mol。
E. 工业合成氨,我们希望提高反应物的转化率并加快反应速率。
F.氨分子内形成氢键,使氨的沸点升高.
G.氮分子的分子间作用力大,使氮分子化学性质很稳定.
H.氢能源属于化石能源.
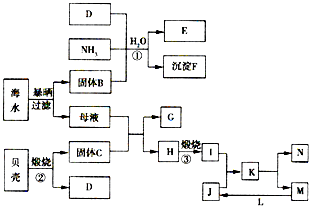 [化学与技术]海洋是巨大的资源宝库,从海洋中我们可以获得各种各样的化学物质,下图是综合利用海洋资源的一个例子(假设海水中存在的离子主要有Na+、Mg2+、Cl-).
[化学与技术]海洋是巨大的资源宝库,从海洋中我们可以获得各种各样的化学物质,下图是综合利用海洋资源的一个例子(假设海水中存在的离子主要有Na+、Mg2+、Cl-).