题目内容
甲图是NO2(g)+CO(g) CO2(g)+NO(g)反应过程能量变化示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态.当改变其中一个条件X,Y随X的变化关系曲线如乙图.下列有关说法正确的是( )
CO2(g)+NO(g)反应过程能量变化示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态.当改变其中一个条件X,Y随X的变化关系曲线如乙图.下列有关说法正确的是( )
A.该反应的焓变△H=+234kJ/mol
B.若X表示反应时间,则Y表示的可能是混合气体的密度
C.若X表示温度,则Y表示的可能是CO2的物质的量浓度
D.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
【答案】分析:A、从能量变化图可知该反应为放热反应;
B、由反应的条件考虑;
C、考虑温度对平衡的影响;
D、考虑反应物浓度的改变对转化率的影响.
解答:解:从能量变化图可知,反应物能量高,生成物能量低,所以该反应为放热反应,△H为“-”,故A错误;
B、因反应过程中体积不变,根据ρ=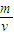 可知,ρ不变,不符合图象,故B错误;
可知,ρ不变,不符合图象,故B错误;
C、根据平衡移动原理,升高温度平衡向吸热方向移动,即向逆反应方向移动,所以CO2的物质的量浓度降低,故C正确;
D、根据平衡移动原理,增大CO的浓度,可提高NO2的转化率,图示转化率降低,故D错误.
故选C.
点评:本题考察了平衡移动原理.关键是搞清反应条件和反应特点,利用平衡移动规律解题.
B、由反应的条件考虑;
C、考虑温度对平衡的影响;
D、考虑反应物浓度的改变对转化率的影响.
解答:解:从能量变化图可知,反应物能量高,生成物能量低,所以该反应为放热反应,△H为“-”,故A错误;
B、因反应过程中体积不变,根据ρ=
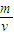 可知,ρ不变,不符合图象,故B错误;
可知,ρ不变,不符合图象,故B错误;C、根据平衡移动原理,升高温度平衡向吸热方向移动,即向逆反应方向移动,所以CO2的物质的量浓度降低,故C正确;
D、根据平衡移动原理,增大CO的浓度,可提高NO2的转化率,图示转化率降低,故D错误.
故选C.
点评:本题考察了平衡移动原理.关键是搞清反应条件和反应特点,利用平衡移动规律解题.

练习册系列答案
相关题目
 CO2(g)+NO(g)反应过程能量变化示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态.当改变其中一个条件X,Y随X的变化关系曲线如乙图.下列有关说法正确的是( )
CO2(g)+NO(g)反应过程能量变化示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态.当改变其中一个条件X,Y随X的变化关系曲线如乙图.下列有关说法正确的是( )




