题目内容
已知Na2Sx可与NaClO发生反应
Na2Sx+NaClO+NaOH Na2SO4+NaCl+H2O
Na2SO4+NaCl+H2O
试配平上述化学方程式.若某多硫化钠在反应中消耗NaClO和NaOH的物质的量的比为2∶1.求x的值及多硫化钠的化学式.
答案:
解析:
提示:
解析:
|
Na2Sx+(3x+1)NaClO+(2x-2)NaOH 【巧解导析】Na2Sx NaClO 所以最小公倍数为6x+2,NaClO和NaCl的系数均为3x+1,再由Na+守恒知NaOH的系数为2x-2,最后由H守恒知H2O的系数为x-1. 因为 |
提示:
|
【巧解点悟】把Na2Sx当作一个整体参加反应 |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
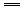 xNa2SO4+(3x+1)NaCl+(x-1)H2O x=5 Na2S5
xNa2SO4+(3x+1)NaCl+(x-1)H2O x=5 Na2S5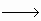 xNa2SO4 化合价升高6x+2
xNa2SO4 化合价升高6x+2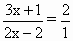 ,所以x=5.
,所以x=5. 变为
变为 必然失电子x(6+
必然失电子x(6+ )=6x+2.切不可把
)=6x+2.切不可把 当作为-2价的硫元素,这样化合价就升高8x.
当作为-2价的硫元素,这样化合价就升高8x.