题目内容
X、Y、Z、W是元素周期表中前30号元素,且原子序数依次增大.其相关信息如下表:
(1)W位于元素周期表第 周期第 族,其基态原子最外层有 个电子.
(2)X的第一电离能比Y的 (填“大”或“小”),1mol X22-中含有的π键数目为 .
(3)X和Y的气态氢化物中,较稳定的是 (写化学式),Y的同族元素(包括Y)的最简单氢化物中沸点最低的是 .
(4)写出KZY3与HZ浓溶液反应制取Z2的化学方程式,并标出电子转移的方向和数目 .
(5)已知:X(s)+Y2(g)═XY2(g)△H1=-393.5kJ?mol-1
XY(g)+
Y2(g)═XY2(g)△H2=-282.9kJ?mol-1
则X(s)与Y2(g)反应生成XY(g)的热化学反应方程式为 .
| 元素 | 相关信息 |
| X | X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z元素的最高正价与负价代数和为6 |
| W | W基态原子未成对电子数是前30号元素中最多的 |
(2)X的第一电离能比Y的
(3)X和Y的气态氢化物中,较稳定的是
(4)写出KZY3与HZ浓溶液反应制取Z2的化学方程式,并标出电子转移的方向和数目
(5)已知:X(s)+Y2(g)═XY2(g)△H1=-393.5kJ?mol-1
XY(g)+
| 1 |
| 2 |
则X(s)与Y2(g)反应生成XY(g)的热化学反应方程式为
考点:位置结构性质的相互关系应用,热化学方程式
专题:基本概念与基本理论,元素周期律与元素周期表专题
分析:X、Y、Z、W是元素周期表中前30号元素,且原子序数依次增大.X原子基态时最外层电子数是其内层电子总数的2倍,原子只能有2个电子层,最外层电子数为4,则X为C元素;Y的基态原子最外层电子排布式为nsnnpn+2,s能级只能容纳2个电子,故n=2,可推知Y为O元素;Z元素的最高正价与负价代数和为6,则Z为Cl;W基态原子未成对电子数是前30号元素中最多的,原子核外电子排布为1s22s22p63s23p63d54s1,则W为Cr,据此解答.
解答:
解:X、Y、Z、W是元素周期表中前30号元素,且原子序数依次增大.X原子基态时最外层电子数是其内层电子总数的2倍,原子只能有2个电子层,最外层电子数为4,则X为C元素;Y的基态原子最外层电子排布式为nsnnpn+2,s能级只能容纳2个电子,故n=2,可推知Y为O元素;Z元素的最高正价与负价代数和为6,则Z为Cl;W基态原子未成对电子数是前30号元素中最多的,原子核外电子排布为1s22s22p63s23p63d54s1,则W为Cr,
(1)W为Cr,位于元素周期表第四周期第ⅥB族,其基态原子最外层有1个电子,
故答案为:四;ⅥB;1;
(2)同周期随原子序数增大,第一电离能呈增大趋势,C元素第一电离能比O元素小,C22-中含有1个碳碳三键,则1mol X22-中含有的π键数目为2NA,
故答案为:小;2NA;
(3)因为O元素的非金属性大于C,所以X和Y的气态氢化物中,较稳定的是H2O;H2O分子间含有氢键,H2O的沸点最高,其它同族氢化物分子间为范德华力,随相对分子质量的增加而增大,所以最简单氢化物中沸点最低的是H2S,
故答案为:H2O;H2S;
(4)KClO3与HCl反应生成KCl、Cl2、H2O,配平可得化学方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O,KClO3中Cl元素由+5价降低为0价,标出电子转移的方向和数目为: ,
,
故答案为: ;
;
(5)已知:①C(s)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1
②CO(g)+
O2(g)═CO2(g)△H2=-282.9kJ?mol-1
根据盖斯定律,①-②得:C(s)+
O2=CO(g)△H=-110.6 kJ?mol-1,
故答案为:C(s)+
O2=CO(g)△H=-110.6 kJ?mol-1.
(1)W为Cr,位于元素周期表第四周期第ⅥB族,其基态原子最外层有1个电子,
故答案为:四;ⅥB;1;
(2)同周期随原子序数增大,第一电离能呈增大趋势,C元素第一电离能比O元素小,C22-中含有1个碳碳三键,则1mol X22-中含有的π键数目为2NA,
故答案为:小;2NA;
(3)因为O元素的非金属性大于C,所以X和Y的气态氢化物中,较稳定的是H2O;H2O分子间含有氢键,H2O的沸点最高,其它同族氢化物分子间为范德华力,随相对分子质量的增加而增大,所以最简单氢化物中沸点最低的是H2S,
故答案为:H2O;H2S;
(4)KClO3与HCl反应生成KCl、Cl2、H2O,配平可得化学方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O,KClO3中Cl元素由+5价降低为0价,标出电子转移的方向和数目为:
 ,
,故答案为:
 ;
;(5)已知:①C(s)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1
②CO(g)+
| 1 |
| 2 |
根据盖斯定律,①-②得:C(s)+
| 1 |
| 2 |
故答案为:C(s)+
| 1 |
| 2 |
点评:本题考查元素的推断、元素周期律和元素周期表、第一电离能的比较、化学键的判断、电子转移、热化学方程式的书写,难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、氨气溶于水所得溶液虽然能导电,但该溶液中不含电解质 |
| B、利用盐类的水解,可用FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 |
| C、在实验室可通过配制相同PH值的盐酸和醋酸,通过多种实验方案对比证明CH3COOH是弱电解质 |
| D、用漂白粉制次氯酸的反应可以说明HClO和CO32-可以共存 |
下列实验过程中,始终无明显现象的是( )
| A、向Al2(SO4)3溶液中通入NH3 |
| B、向NaHCO3溶液中滴入烧碱溶液 |
| C、向淀粉-KI溶液中通入NO2气体 |
| D、向含酚酞的NaOH溶液中通入SO2气体 |
有两种饱和一元醇,它们分子中的碳原子个数相差1,已知它们的某种混合物8g与足量金属钠反应后可生成2.24L(标准状况)氢气,则它们分别是( )
| A、甲醇、乙醇 |
| B、甲醇、丙醇 |
| C、丙醇、丁醇 |
| D、丁醇、戊醇 |

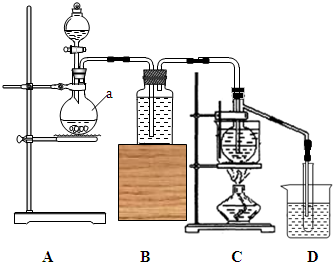 实验室利用如图所示装置,用电石为原料,在90℃左右,用HgSO4催化乙炔水化制备乙醛.(已知常温下乙炔在水中溶解度约为1:1(体积比))
实验室利用如图所示装置,用电石为原料,在90℃左右,用HgSO4催化乙炔水化制备乙醛.(已知常温下乙炔在水中溶解度约为1:1(体积比))