题目内容
 某溶液是由盐酸、稀硫酸、硫酸铁溶液、氯化铁溶液、稀硝酸、硝酸铁溶液几种中的两种混合而成,向该溶液中滴加Ba(OH)2溶液的体积与生成沉淀的质量关系如图所示,则该溶液是
某溶液是由盐酸、稀硫酸、硫酸铁溶液、氯化铁溶液、稀硝酸、硝酸铁溶液几种中的两种混合而成,向该溶液中滴加Ba(OH)2溶液的体积与生成沉淀的质量关系如图所示,则该溶液是
- A.稀硝酸、氯化铁
- B.稀硫酸、硝酸铁
- C.稀硫酸、氯化铁
- D.盐酸、硫酸铁
分析:依据向该溶液中滴加Ba(OH)2溶液的体积与生成沉淀的质量关系图象可知,开始无沉淀生成说明是中和酸的过程,因为硫酸钡难溶于酸,所以判断一定不含稀硫酸、硫酸铁溶液;其它物质可以是盐酸和氯化铁或硝酸铁形成的混合物,也可以是硝酸和氯化铁或硝酸铁形成的混合物.
解答:依据向该溶液中滴加Ba(OH)2溶液的体积与生成沉淀的质量关系图象可知,开始无沉淀生成说明是中和酸的过程,因为硫酸钡难溶于酸,判断一定不含稀硫酸、硫酸铁溶液;随着酸的反应完全会生成沉淀,证明一定含铁离子,形成沉淀为氢氧化铁;其它物质可以是盐酸和氯化铁或硝酸铁形成的混合物,也可以是硝酸和氯化铁或硝酸铁形成的混合物;
A、稀硝酸、氯化铁符合题意,故A正确;
B、加入氢氧化钡,开始无沉淀生成,一定不含硫酸,故B错误;
C、加入氢氧化钡,开始无沉淀生成,一定不含硫酸,故C错误;
D、加入氢氧化钡,开始无沉淀生成,一定不含硫酸铁,故D错误;
故选A.
点评:本题考查了物质性质的检验方法,明确图象中开始没有沉淀来确定溶液的成分是解答的关键,注意硫酸钡是不溶于酸的沉淀,题目难度不大.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案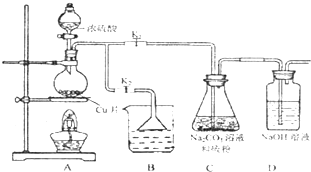 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.
(1)某研究小组设计了制备Na2S203_5H20装置和部分操作步骤如图.
I.打开K1关闭K2,向圆底烧瓶中加入足量浓硫酸,加热.
II.C中混合液被气流搅动,反应一段时间后,硫粉的域逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热.
III.过滤C中的混合液.
IV.将滤液经过
①II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是
②IV中,操作步骤是
③装置B中盛放的试剂是(填化学式)
④有一小组在实验中发现,二氧化硫气体产生缓慢以致后续现象不明显,但又不存在气密性问题,请你推测可能的原因
(2)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO
2- 4 |
2- 7 |
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
①Cr2O
2- 7 |
②I2+2S2O
2- 3 |
2- 6 |
则判断达到滴定终点的现象是
(14分)不同的金属在化学反应中表现出来的活泼程度不同,瑞典化学家贝采里乌斯和俄国化学家贝开托夫称之为金属活动顺序。另一方面,同一金属在不同条件或不同化学反应中也可以表现出不同的活泼程度。
⑴根据金属活动性顺序,工业上冶炼金属可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属有 。
腐蚀速率/g.m-2.h-1
 ⑵工业上用氯化铁溶液腐蚀铜制电路板。根据金属活动性顺序及该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性由强到弱的顺序: 。
⑵工业上用氯化铁溶液腐蚀铜制电路板。根据金属活动性顺序及该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性由强到弱的顺序: 。
⑶合金Fe-Cr在不同酸中反应情况不同,其在三种稀硫
酸、稀硝酸和稀盐酸中的腐蚀速率如图所示,则下列
有关说法正确的是 (填写序号)。
A.酸的氧化性越强,对该合金的腐蚀速率越大
B.稀硝酸对该合金的腐蚀性比另两种酸弱
C.合金中Cr含量增加,稀硝酸对该合金的腐蚀性减弱
⑷已知粗铜中含有少量的锌、铁、银、金等金属和少量
|
以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,
并对阳极泥和电解液中金属进行回收。
步骤一:电解精制
电解时,粗铜应与电源的 极相连。电解过程中,硫酸铜的浓度会 (填“变大”、“不变”或“变小”)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl- = AuCl4- | >>1 |
从表中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1:3的混合物),请你简要解释金能够溶于王水的原因: 。
(15分)高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下: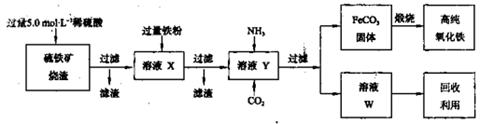
回答下列问题: (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(填写仪器名称)。
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处: ;
②过滤后,洗涤过滤器中少量沉淀的方法是 。
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2
①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH
e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 和 (用药品序号填空);装置D处药品的最佳选择为 和 (用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
| A.MnO2与浓盐酸反应制备Cl2 |
| B.Cu与浓硫酸反应生成SO2 |
| C.由KMnO4分解制O2 |
| D.乙醇与乙酸反应制备乙酸乙酯 |
③写出上述装置A处的试管中所发生反应的化学方程式 。
④若通入一定量的NH3和CO2后,装置C处的溶液中只含有S、N、H、O四种元素。用pH试纸测定该溶液pH的方法是 ;若该溶液呈中性,则溶液中的NH+4和SO2-4的物质的量浓度间的数量关系为 。(离子的浓度用符号[NH+4]和[SO2-4]表示)

 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。
 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。