题目内容
【题目】锌焙砂是锌精矿经焙烧后所得的产物,以锌焙砂为原料制取金属锌的流程如图所示。
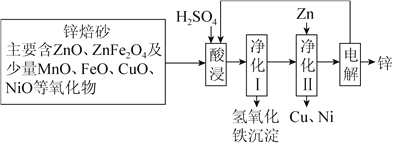
已知:①当溶液中Zn2+浓度较大时,Zn2+优先于H+放电。
②碱性条件下Mn(Ⅱ)可以被氧气氧化生成Mn(Ⅵ)。
请回答下列问题:
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为_____________________________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:___________。
②25 ℃时,pH=3的滤液(滤去氢氧化铁沉淀)中,c(Fe3+)=________mol·L-1(已知25 ℃时,Ksp[Fe(OH)3]=4.0×10-38)。
(3)电解硫酸锌溶液时阳极上有气体析出,写出阳极的电极反应式_____________________________;
电解时不断补充电解液的目的是_________________________。
(4)电解时,阳极附近发生化学反应生成HMnO4,使得溶液变为紫红色,生成的HMnO4,又将Mn2+氧化生成MnO2,一部分二氧化锰沉于槽底形成阳极泥,另一部分附于阳极表面形成保护膜。写出HMnO4将Mn2+氧化生成MnO2的化学方程式__________________。
【答案】 ZnFe2O4+4H2SO4===ZnSO4+Fe2(SO4)3+4H2O H2O2+2Fe2++2H+===2Fe3++2H2O 4.0×10-5 4OH--4e-=2H2O+O2↑ 保持溶液中Zn2+的浓度处于较高水平,以保证阴极上能稳定析出锌 3MnSO4+2HMnO4+2H2O===5MnO2↓+3H2SO4
【解析】试题分析:(1)酸浸时ZnFe2O4与硫酸反应会生成ZnSO4、Fe2(SO4)3两种盐;(2) ①酸性条件下H2O2把Fe2+氧化为Fe3+;②根据 ![]() 计算c(Fe3+);(3)电解硫酸锌溶液时阳极上氢氧根离子放电生成氧气;根据“当溶液中Zn2+浓度较大时,Zn2+优先于H+放电”回答不断补充电解液的目的;(4)根据氧化还原反应规律,HMnO4与Mn2+发生归中反应生成MnO2;
计算c(Fe3+);(3)电解硫酸锌溶液时阳极上氢氧根离子放电生成氧气;根据“当溶液中Zn2+浓度较大时,Zn2+优先于H+放电”回答不断补充电解液的目的;(4)根据氧化还原反应规律,HMnO4与Mn2+发生归中反应生成MnO2;
解析:(1)酸浸时ZnFe2O4会生成ZnSO4、Fe2(SO4)3两种盐,反应方程式是ZnFe2O4+4H2SO4===ZnSO4+Fe2(SO4)3+4H2O;(2) ①酸性条件下H2O2把Fe2+氧化为Fe3+的离子方程式是H2O2+2Fe2++2H+===2Fe3++2H2O;②PH=3,![]() ,
,![]() ,c(Fe3+)=
,c(Fe3+)=![]() 4.0×10-5;(3)电解硫酸锌溶液时阳极上氢氧根离子放电生成氧气,阳极反应式是4OH--4e-=2H2O+O2↑;电解时不断补充电解液的目的是保持溶液中Zn2+的浓度处于较高水平,以保证阴极上能稳定析出锌;(4)HMnO4与Mn2+发生归中反应生成MnO2,化学方程式3MnSO4+2HMnO4+2H2O===5MnO2↓+3H2SO4;
4.0×10-5;(3)电解硫酸锌溶液时阳极上氢氧根离子放电生成氧气,阳极反应式是4OH--4e-=2H2O+O2↑;电解时不断补充电解液的目的是保持溶液中Zn2+的浓度处于较高水平,以保证阴极上能稳定析出锌;(4)HMnO4与Mn2+发生归中反应生成MnO2,化学方程式3MnSO4+2HMnO4+2H2O===5MnO2↓+3H2SO4;

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】下列依据实验操作及现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2 溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3 > C12 |
C | 向待测液中依次滴入氯水和KSCN 溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. A B. B C. C D. D
【题目】目前,人们对环境保护、新能源开发很重视。
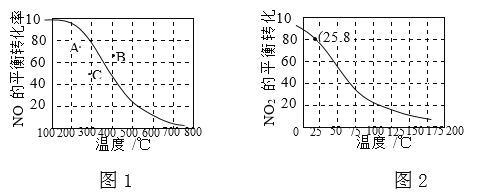
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,能使有毒气体转化为无毒气体:4CO(g)+2N02(g)![]() C02(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是_____填字母);
C02(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是_____填字母);
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C. 2v逆(NO2)=v正(N2)
D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g)△H。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
浓度/mol·L-1 | ||||||
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析Tl℃时,该反应在0~20 min的平均反应速率v(C02)=___;计算该反应的平衡常数K=____。(保留两位有效数字)
②根据上表数据判断,由30 min到40 min时改变的条件可能是(任写一种)_____。
(3)以CO2span>与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式____。
(4)科学家利用原电池原理,在酸性溶液中将N02转化为HN03,则该转化的负极电极方程式为____。