题目内容
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
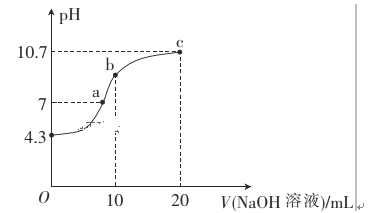
①写出H2N2O2在水溶液中的电离方程式:______________。
②b点时溶液中c(H2N2O2)_____ c(N2O22-)(填“>”、“<”或“=”,下同)。
③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中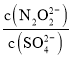 =__________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=__________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
【答案】H2N2O2 HN2O2—+H+ (HN2O2— N2O22— +H+) > > 3.0×10—4.
【解析】
(1)①根据图象可知,0.01mol/L的H2N2O2溶液pH=4.3,说明H2N2O2为二元弱酸,分步电离,且以第一部电离为主;
②b点时溶液的溶质为NaHN2O2,溶液呈碱性,那么HN2O2-的水解程度大于电离程度;
③a点时溶液的pH=7,溶液呈中性,c(H+)=c(OH-),根据电荷守恒进行判断;
(2)根据Ksp(Ag2N2O2)=c2(Ag+)c(N2O22-),Ksp(Ag2SO4)= c2(Ag+)c(SO42-),分别计算出c(N2O22-)和c(SO42-),最后求比值。
(1)①根据图象可知,0.01mol/L的H2N2O2溶液pH=4.3,说明H2N2O2为二元弱酸,分步电离,且以第一部电离为主,因此电离方程式为:H2N2O2 HN2O2-+H+ (HN2O2- N2O22-+H+);
②b点时溶液的溶质为NaHN2O2,溶液呈碱性,那么HN2O2-的水解程度大于电离程度,因此c(H2N2O2) > c(N2O22-);
③a点时溶液的pH=7,溶液呈中性,c(H+)=c(OH-),根据电荷守恒有c(Na+)=c(HN2O2-)+2c(N2O22-),因此c(Na+)>c(HN2O2-)+c(N2O22-);
(2)根据Ksp(Ag2N2O2)=c2(Ag+)c(N2O22-)和 Ksp(Ag2SO4)= c2(Ag+)c(SO42-)可得c(N2O22-)= ,c(SO42-)=
,c(SO42-)= ,因此
,因此 =
= =
= =
=![]() =3.0×10-4。
=3.0×10-4。

【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜