题目内容
3.下列说法不正确的是( )①质子数相同的微粒一定属于同一种元素;
②同位素的性质几乎相同;
③一种元素只能有一种质量数;
④Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
| A. | ① | B. | ①② | C. | ①②③ | D. | ①②③④ |
分析 ①具有相同质子数的原子一定属于同种元素,但微粒可能为原子、分子、离子等;
②同位素的物理性质不同;
③根据原子的质量数=质子数+中子数,而同一元素的质子数相同,中子数可能不同;
④同位素原子在不同物质中个数之比不变.
解答 解:①具有相同质子数的原子一定属于同种元素,但微粒可能为原子、分子、离子等,如Na+、NH4+的质子数都是11,HF、Ne的质子数都是10,但不是同种元素,故①错误;
②同位素的物理性质不同,化学性质相同,故②错误;
③原子的质量数=质子数+中子数,而同一元素的质子数相同,中子数可能不同,所以同种元素的原子其质量数不一定相等,故③错误;
④同位素原子在不同物质中个数之比不变,所以C12中35C1与37Cl两种核素的个数之比与HC1中35Cl与37Cl的个数之比相等,故④正确;
故选C.
点评 本题主要考查的是原子结构、同位素、核素等,难度不大,注意把握同位素概念的内涵与外延.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
13.室温下,1体积气态烃和一定量氧气混合并充分燃烧后,再冷却至室温,气体体积比反应前缩小了3体积,则气态烃是( )
| A. | 丙烷 | B. | 乙烯 | C. | 丁烷 | D. | 丁炔 |
14.下列离子方程式书写正确是( )
| A. | 氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-=2Fe2++S↓ | |
| C. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| D. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
11. C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )
C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )
 C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )
C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )| A. | 电池放电时,溶液中钠离子向负极移动 | |
| B. | 该电池负极的电极反应为:NaMO2-xe-═Na(1-x)MO2+xNa+ | |
| C. | 消耗相同质量金属时,用锂作负极产生电子的物质的量比用钠时少 | |
| D. | 电池充电时的阳极反应式为:nC+x Na+-xe-═NaxCn |
18.要加快H2O2分解的速度,下列措施不可行的是( )
| A. | 加热或光照 | B. | 加MnO2或FeCl3 | C. | 加压 | D. | 增大H2O2的浓度 |
8.300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol•L-1 Ba(OH)2溶液300mL,反应后溶液中SO42-的物质的量浓度为( )
| A. | 0.4mol•L-1 | B. | 0.3mol•L-1 | C. | 0.2mol•L-1 | D. | 0.1mol•L-1 |
15. 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A. | ④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物 | |
| B. | ⑤的三种核素的化学性质不相同 | |
| C. | ⑥、⑧、⑨对应单核离子的半径依次增大 | |
| D. | ⑧、⑨两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
12.下列变化属于化学变化的是( )
| A. | 碘的升华 | B. | 碘化银用于人工降雨 | ||
| C. | 液溴的气化 | D. | 漂白粉久置失效 |
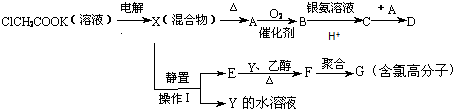
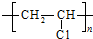 .
. .
.