题目内容
【题目】Ⅰ、钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
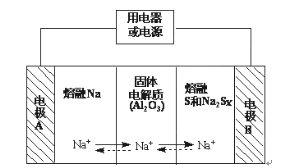
(1)请判断该电池工作的适宜温度应控制在____范围内(填字母序号)。
A.常温 B.60℃~ 100℃ C.200℃~350℃ D.2000℃~3000℃
(2)放电时,电极A为___极。
(3)放电时,内电路中Na+的移动方向为___(填“从A到B”或“从B到A”)。
(4)充电时,总反应为Na2Sx=2Na+xS(3<x<5),则阳极的电极反应式为___。
Ⅱ、用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)
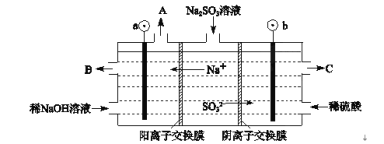
(1)图中a极要连接电源的(填“正”或“负”)___极,C口流出的物质是___。
(2)SO32-放电的电极反应式为____。
(3)电解过程中阴极区碱性明显增强,请结合电极方程式解释原因___。
【答案】C 负 从A到B Sx2--2e-=xS 负 硫酸 SO32--2e-+H2O=SO42- +2H+ 2H2O+2e-=H2↑+2OH-
【解析】
I.该装置放电时为原电池,负极为Na失电子生成钠离子,正极为S得电子生成Sx2-;充电时为电解池,阴极为钠离子得电子生成钠,阳极为Sx2--2e-=xS;
Ⅱ.此装置为电解池,溶液中的阳离子向阴极移动,阴离子向阳极移动,则a为负极,b为正极,阳极为亚硫酸根离子在阳极失去电子发生氧化反应生成硫酸根离子;阴极:2H2O+2e-=H2↑+2OH-;
I.(1)电池工作时,要求为熔融状态的Na、S,根据物质的熔点表中数据,温度应高于115℃,小于444.6℃,答案为C;
(2)放电时,Na失电子生成钠离子,则A电极做负极;
(3)放电时,电池内部中阳离子向正极移动,则Na+的移动方向为从A到B;
(4)充电时为电解池,阳极Sx2-失电子,生成xS,电极反应式为Sx2--2e-=xS;
II. (1)根据图像可知,此装置为电解池,溶液中的Na+向阴极移动,则a与电池负极相连;b极为亚硫酸根离子在阳极失去电子发生氧化反应生成硫酸根离子,则C口流出的为浓度较大的硫酸;
(2)SO32-放电的电极反应式为SO32--2e-+H2O=SO42- +2H+;
(3)电解过程中阴极区发生2H2O+2e-=H2↑+2OH-,使溶液中的氢氧根离子浓度增大,碱性增强。

 阅读快车系列答案
阅读快车系列答案【题目】目前我国研制的稀土催化剂催化转化汽车尾气示意图如下:
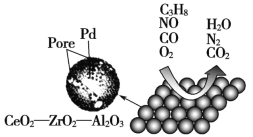
(1)Zr原子序数为40,价电子排布式为4d25s2,它在周期表中的位置是_______________。
(2)图中互为等电子体的两种气体分子是_____________。
(3)C3H8中所有碳原子的杂化方式是___________。
(4)图中属于非极性的气体分子是_______________________。
Fe、Mn元素的部分电离能数据列于下表中
元素 | Fe | Mn | |
电离能(kJ·mol-1) | I1 | 759 | 717 |
I2 | 1561 | 1509 | |
I3 | 2957 | 3248 | |
(5)从上表两元素部分电离能数据比较的可知,气态Mn2+再失去一下电子比气态Fe2+再夫去一个电子难,原因是_____________。
(6)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,镍原子在基态时核外电子排式为_____________,[Ni(CO)4]的配体是_________,配位原子是__________。
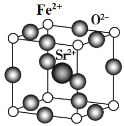
(7)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图所示,则与每个Sr2+紧邻的O2-有______个。
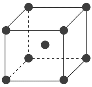
(8)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格,原子半径为apm,相对原子质量为b,阿伏加德罗常数为NA,试计算晶体铌的密度为______________g·cm-3(用来a、b、NA表示计算结果)。
【题目】碘在科研与生活中有重要应用,某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知S2O82-+2I-=2SO42-+I2(慢) I2+2S2O32-= 2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的___耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为n(S2O32-)∶n(S2O82-)___。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表
实验序号 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx__mL,理由是___。
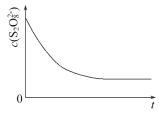
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)____
【题目】 运用化学反应原理研究碳、氮、硫的化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)有科学家经过研究发现,用CO2和H2在210~ 290℃, 催化剂条件下可转化生成甲醇蒸汽和水蒸气。230℃,向容器中投入0.5mol CO2和1.5mol H2.当CO2平衡转化率达80%时放出的热量为19. 6kJ,写出该反应的热化学方程式∶___________。
(2)在2L密闭容器中,起始投人4mol CO和6mol H2,在一定条件下发生反应CO(g)+2H2(g)![]() CH3OH(g),平衡时仅改变温度测得的数据如下表所示∶ (已知:T1<T2)
CH3OH(g),平衡时仅改变温度测得的数据如下表所示∶ (已知:T1<T2)
温度/℃ | 平衡时CH3OH的物质的量/ mol | 化学平衡常数 |
T1 | 2.6 | K1 |
T2 | 2.0 | K2 |
①则K1_______(填“>”“<”或“=”) K2,原因是_________________。
②在T2下,经过10s达到化学平衡状态,则0~ 10s内H2的平均速率v(H2)为_______,若维持条件不变再向容器中充入CO、H2和CH3OH各1mol,则v正_________(填“>”“<”或“=”)v逆。
(3)某科研小组设计的一个氮氧化物原电池 ,两边的阴影部分为 a、b惰性电极,分别用导线与烧杯的m、n惰性电极相连接,工作原理如图:

①b极的电极反应式为_______________________。
②当有0.2mol O2-通过固体电解质时,则烧杯中m处的产物的物质的量为________。
(4)处理烟气中SO2,也可采用碱液吸收法,已知25°C时,K(NH3 H2O)=1.8×10-5; Kcp(CaSO4)=7.1×10-5.
第1步∶用过量的浓氨水吸收SO2,并在空气中氧化;
第2步∶加入石灰水,发生反应![]() K。计算第2步中反应的K=_____________(列出计算式即可)。
K。计算第2步中反应的K=_____________(列出计算式即可)。