题目内容
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1
下列有关反应速率的比较中正确的是
A.④>③=②>① B.④<③=②<① C.①>②>③>④ D.④>③>②>①
A
解析试题分析:都用同种物质速率来表示,然后再比较其大小。不妨用A的速率来表示。②v(A)="1∕3" v(B)="0.2" mol·L-1·s-1③v(A)="1∕2" v(C)="0.2" mol·L-1·s-1④v(A) =1∕2v(D)=0.225 mol·L-1·s-1反应速率的比较中正确④>③=②>①。选项为:A.
考点:考查反应速率的大小比较的知识。

 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
D.对于2HI(g) H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
关于平衡常数,下列说法不正确的是
| A.平衡常数随温度的改变而改变 |
| B.使用催化剂不能改变平衡常数 |
| C.平衡常数不随反应物或生成物浓度的改变而改变 |
| D.增大压强促使平衡向正反应方向进行,则平衡常数增大 |
可逆反应2SO2(g) +O2(g) 2SO3(g)在不同条件下的反应速率如下,其中反应速率最快的是 ( )
2SO3(g)在不同条件下的反应速率如下,其中反应速率最快的是 ( )
| A.υ(SO2)=0.5mol/(L?s) | B.υ(O2)=1mol/(L?min) |
| C.υ(SO3)=0.6mol/(L?s) | D.υ(O2)=0.4mol/(L?s) |
将1.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,一定条件下发生反应:PCl3(g)+ Cl2(g) PCl5(g),达到平衡时PCl5为0.3mol·L-1,如果此时再充入1.0 molPCl3和1.0 mol Cl2,在相同温度下再达到平衡时,PCl5的物质的量浓度是
PCl5(g),达到平衡时PCl5为0.3mol·L-1,如果此时再充入1.0 molPCl3和1.0 mol Cl2,在相同温度下再达到平衡时,PCl5的物质的量浓度是
| A.0.6mol·L-1 | B.大于0.3 mol·L-1,小于0.6 mol·L-1 |
| C.大于0.6 mol·L-1 | D.小于0.3 mol·L-1 |
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) 2 HBr(g) ΔH<0平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
2 HBr(g) ΔH<0平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
| A.a>b | B.a=b | C.a<b | D.无法确定 |
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是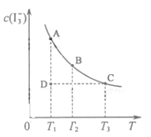
A.反应 I2(aq)+I-(aq) I3-(aq)的ΔH<0 I3-(aq)的ΔH<0 |
B.若温度为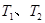 ,反应的平衡常数分别为K1、K2,则K1>K2 ,反应的平衡常数分别为K1、K2,则K1>K2 |
C.若反应进行到状态D时,一定有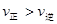 |
| D.状态A与状态B相比,状态A的c(I2)大 |
在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol N2、3 mol H2 | 4 mol NH3 |
| NH3的浓度(mol·L-1) | c1 | c2 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ |
| 气体密度 | ρ1 | ρ2 |
| 反应物转化率 | α1 | α2 |
 (已知N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ·mol-1),下列说法正确的是( )
(已知N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ·mol-1),下列说法正确的是( )A.c1<c2<2c1 B.a+b>92.4 C.α1+α 2=1 D.ρ2=2ρ1