题目内容
由化学能产生的能量是目前人类使用的主要能源。请回答下列问题:
(1)N2和O2在一定条件下反应生成NO2的热化学方程式为:
![]() N2(g)+O2(g)====NO2(g) ΔH=+34 kJ·mol-1。该反应为_____________(“放热”“吸热”)反应。
N2(g)+O2(g)====NO2(g) ΔH=+34 kJ·mol-1。该反应为_____________(“放热”“吸热”)反应。
(2)化学反应中的能量变化源自于化学反应中化学键变化时产生的能量变化。下表为一些化学键的键能:
| 化学键 | 键能( kJ·mol-1) | 化学键 | 键能( kJ·mol-1) |
| N≡N | 942 | H—O | 460 |
| N—H | 391 | O==O | 499 |
| H—H | 437 |
①写出N2和H2反应合成氨的热化学方程式_________________________。
② 已知:1 mol H2O(g)转化为1 mol H2O(l)时放出44.0 kJ的热量。计算1 g H2完全燃烧时放出的热量___________________。H2O(g)的稳定性___________(“大于”“小于”)H2O(l)。
(3)写出NH3(g)在O2(g)中完全燃烧生成NO2(g)和H2O(g)的热化学方程式_________________________________________________________________________。
(1)吸热
(2)①![]()
![]()
![]()
②138.8 kJ 小于
(3)4NH3(g)+7O2(g)====4NO2(g)+6H2O(g) ΔH=-1 079 kJ·mol-1
解析:
(1)ΔH=+34 kJ·mol-1即ΔH>0为吸热反应。
(2)①N2和H2反应合成氨的反应热ΔH=942 kJ·mol-1+3×437 kJ·mol-1-2×3×391 kJ·mol-1=-93 kJ·mol-1,则N2和H2反应合成氨的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-93 kJ·mol-1。②H2的燃烧热为:(437 kJ·mol-1+0.5×499 kJ·mol-1-2×460 kJ·mol-1)+44.0 kJ·mol-1=-277.5 kJ·mol-1,则1 g H2完全燃烧时放出的热量为:277.5 kJ·mol-1×0.5 mol=138.8 kJ。由于H2O(g)转化为H2O(l)时放出热量,故H2O(g)的稳定性小于H2O(l)。
2NH3(g) ΔH=-93 kJ·mol-1。②H2的燃烧热为:(437 kJ·mol-1+0.5×499 kJ·mol-1-2×460 kJ·mol-1)+44.0 kJ·mol-1=-277.5 kJ·mol-1,则1 g H2完全燃烧时放出的热量为:277.5 kJ·mol-1×0.5 mol=138.8 kJ。由于H2O(g)转化为H2O(l)时放出热量,故H2O(g)的稳定性小于H2O(l)。
(3)NH3(g)在O2(g)中完全燃烧生成NO2(g)和H2O(g)的化学反应方程式为:4NH3+7O2====4NO2+6H2O,据此求得该反应的反应热ΔH=4×3×391 kJ·mol-1+7×499 kJ·mol -1-4×(0.5×942 kJ·mol-1+499 kJ·mol-1-34 kJ·mol-1)-6×2×460 kJ·mol-1= -1 079 kJ·mol-1,其热化学方程式为:4NH3(g)+7O2(g)====4NO2(g)+6H2O(g) ΔH=-1 079 kJ·mol-1

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案由化学能产生的能量是目前人类使用的主要能源。回答下列问题:
⑴ N2和O2在一定条件下反应生成NO2的热化学方程式为:
![]() N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
⑵ 化学反应中的能量变化源自于化学反应中化学键变化时产生的能量变化。下表为一些化学键的键能:
| 化学键 | 键能(kJ/mol) | 化学键 | 键能(kJ/mol) |
| N≡N | 942 | H-O | 460 |
| N-H | 391 | O=O | 499 |
| H-H | 437 |
① 写出N2和H2反应合成氨的热化学方程式 。
② 已知:1molH2O(g)转化为1molH2O(l)时放出44.0 kJ的热量。计算1g H2完全燃烧时放出的热量 。H2O(g)的稳定性 (“大于”、“小于”)H2O(l)。
⑶ 写出NH3(g)在O2(g)中完全燃烧生成NO2(g)和H2O(g)的热化学方程式 。
由化学能产生的能量是目前人类使用的主要能源。回答下列问题:
⑴ N2和O2在一定条件下反应生成NO2的热化学方程式为:
![]() N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
⑵ 化学反应中的能量变化源自于化学反应中化学键变化时产生的能量变化。下表为一些化学键的键能:
| 化学键 | 键能(kJ/mol) | 化学键 | 键能(kJ/mol) |
| N≡N | 942 | H-O | 460 |
| N-H | 391 | O=O | 499 |
| H-H | 437 |
① 写出N2和H2反应合成氨的热化学方程式 。
② 已知:1molH2O(g)转化为1molH2O(l)时放出44.0 kJ的热量。计算1g H2完全燃烧时放出的热量 。H2O(g)的稳定性 (“大于”、“小于”)H2O(l)。
⑶ 写出NH3(g)在O2(g)中完全燃烧生成NO2(g)和H2O(g)的热化学方程式 。
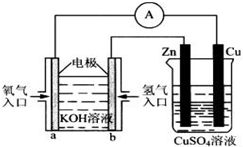 Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液.通过相同电量时,阴极产生的气体物质的量相同的是(填序号)
Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液.通过相同电量时,阴极产生的气体物质的量相同的是(填序号)