题目内容
有pH=4的盐酸、硫酸、醋酸三瓶溶液:(以下均用>、<、=表示)
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是
(4)取同体积的酸溶液分别加入足量的锌粉,反应开始放出H2的速率依次为υ1、υ2、υ3,则其关系是
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是
c3>c1>c2
c3>c1>c2
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是
V1=V2<V3
V1=V2<V3
.(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是
n1=n3>n2
n1=n3>n2
.(4)取同体积的酸溶液分别加入足量的锌粉,反应开始放出H2的速率依次为υ1、υ2、υ3,则其关系是
υ1=υ2=υ3
υ1=υ2=υ3
;反应过程中放出H2的速率依次为υa、υb、υc,则其关系是υa=υb<υc
υa=υb<υc
;产生氢气的质量依次为m1、m2、m3,则其关系是m1=m2<m3
m1=m2<m3
.分析:盐酸为一元强酸,硫酸为二元强酸,醋酸为弱酸,等pH时,醋酸浓度最大,硫酸浓度最小,加水稀释促进醋酸的电离,如稀释等pH时,醋酸加水应最多,结合浓度对反应速率的影响解答该题.
解答:解:盐酸为一元强酸,硫酸为二元强酸,醋酸为弱酸,
(1)等pH时,醋酸浓度最大,硫酸浓度最小,则浓度大小顺序为c3>c1>c2,故答案为:c3>c1>c2;
(2)加水稀释促进醋酸的电离,如稀释等pH时,醋酸加水应最多,而盐酸和硫酸为强酸,完全电离,稀释到pH=6,加水的体积相等,则有V1=V2<V3,故答案为:V1=V2<V3;
(3)醋酸和盐酸都为一元酸,硫酸为二元酸,完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则有n1=n3>n2,
故答案为:n1=n3>n2;
(4)三种溶液pH相等,则c(H+)相等,反应开始放出H2的速率依次为υ1、υ2、υ3,则其关系是υ1=υ2=υ3,随着反应的进行,醋酸不断电离出H+,则醋酸中H+浓度大于盐酸和硫酸,则有υa=υb<υc,且醋酸生成的氢气的质量最大,而盐酸和硫酸生成的氢气的质量相同,则有m1=m2<m3,
故答案为:υ1=υ2=υ3;υa=υb<υc;m1=m2<m3.
(1)等pH时,醋酸浓度最大,硫酸浓度最小,则浓度大小顺序为c3>c1>c2,故答案为:c3>c1>c2;
(2)加水稀释促进醋酸的电离,如稀释等pH时,醋酸加水应最多,而盐酸和硫酸为强酸,完全电离,稀释到pH=6,加水的体积相等,则有V1=V2<V3,故答案为:V1=V2<V3;
(3)醋酸和盐酸都为一元酸,硫酸为二元酸,完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则有n1=n3>n2,
故答案为:n1=n3>n2;
(4)三种溶液pH相等,则c(H+)相等,反应开始放出H2的速率依次为υ1、υ2、υ3,则其关系是υ1=υ2=υ3,随着反应的进行,醋酸不断电离出H+,则醋酸中H+浓度大于盐酸和硫酸,则有υa=υb<υc,且醋酸生成的氢气的质量最大,而盐酸和硫酸生成的氢气的质量相同,则有m1=m2<m3,
故答案为:υ1=υ2=υ3;υa=υb<υc;m1=m2<m3.
点评:本题考查弱电解质的电离,侧重于弱电解质的电离特点与平衡移动的考查,题目难度不大,注意把握弱电解质的电离原理和影响平衡移动的因素,易错点为(3),注意中和反应的特点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2NH3(g)△H=-92kJ?mol-1
2NH3(g)△H=-92kJ?mol-1 Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq) H++HCO3-
H++HCO3-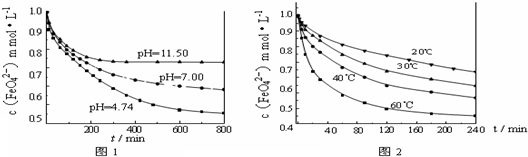


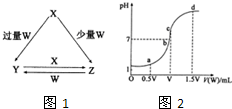 (2013?菏泽二模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去).
(2013?菏泽二模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去). 