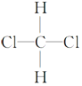
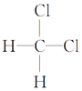
题目内容
【题目】(1)加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是_______。
(2)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为____________。
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等,除去100 L锅炉水中![]() 含氧气8 g/L的溶解氧,需要肼的质量为__________。
含氧气8 g/L的溶解氧,需要肼的质量为__________。
【答案】6Fe2++6H++ClO3-![]() 6Fe3++Cl-+3H2O 2CoCO3
6Fe3++Cl-+3H2O 2CoCO3![]() Co2O3+CO↑+CO2↑ 800 g
Co2O3+CO↑+CO2↑ 800 g
【解析】
(1)Fe2+具有还原性,ClO3-具有氧化性,在酸性条件下会将Fe2+转化为Fe3+,ClO3-被还原为Cl-;
(2)CoCO3隔绝空气灼烧可以生成Co2O3,根据化合价升降守恒及原子守恒,配平化学方程式;
(1)亚铁离子被氯酸根离子氧化成铁离子,1 mol的亚铁离子转化为铁离子,失去1 mol的电子,而1 mol的氯酸根离子变为氯离子得到6 mol的电子,根据电子得失守恒,可知Fe2+、Fe3+的系数是6,ClO3-、Cl-的系数是1,根据电荷守恒,可知H+系数是6,最后根据原子守恒,可得H2O的系数是3,该反应的离子方程式为:6Fe2++6H++ClO3-![]() 6Fe3++Cl-+3H2O;
6Fe3++Cl-+3H2O;
(2)CoCO3隔绝空气灼烧可以生成Co2O3,Co元素化合价由+2价变为+3价,升高1×2=2价,则碳元素化合价由+4价变为+2价,化合价降低2,由Co原子守恒可知2 molCoCO3生成1 mol Co2O3,C原子为2 mol,降低2价,说明其中生成1 molCO,还有1 molC仍然为+4价,物质是CO2气体,反应方程式为2CoCO3![]() Co2O3+CO↑+CO2↑;
Co2O3+CO↑+CO2↑;
(3)肼除氧的反应是肼和氧气反应产生N2和水,反应方程式为N2H4+O2=N2+2H2O,100 L锅炉水(含氧气8 g/L)的溶解氧,其中含有的氧气的物质的量n(O2)=![]() =25 mol,则根据方程式可知反应消耗肼的物质的量为25 mol,其质量为m(N2H4)=25 mol×32 g/mol=800 g。
=25 mol,则根据方程式可知反应消耗肼的物质的量为25 mol,其质量为m(N2H4)=25 mol×32 g/mol=800 g。

【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
【题目】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:
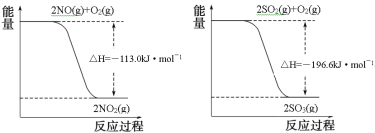
写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式___。
(2)向容积为1L密闭容器中分别充入0.10molNO2和0.15molSO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示。
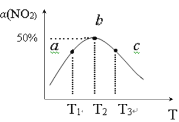
①a、c两点反应速率大小关系:υ(a)___υ(c)。(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为___,此温度下该反应的平衡常数为___,若在此温度下,保持容器的容积不变,再向容器中充入0.20molNO2和0.30molSO2,NO2的转化率___。(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是:___。
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32-)∶n(HSO3-)变化关系如下表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___。