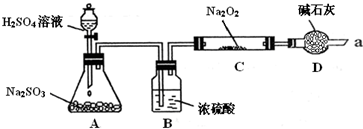
题目内容
某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验.
完成下列问题:

(1)仪器a的名称是________,应盛放下列药品中的________.
A.稀硫酸
B.亚硫酸
C.氢硫酸
D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________.
A.碳酸钙
B.硫酸钠
C.氯化钠
D.碳酸钠
(3)仪器c中应盛放的样品是________,如果看到的现象是________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力比强,b中发生反应的离子方程式为________.
答案:
解析:
解析:
|
答案:(1)分液漏斗 A (2)圆底烧瓶 D (3)澄清石灰水 澄清石灰水变浑浊 CO2 H2SO4 H2CO3 S C +2H+ 解析:要证明S比C的得电子能力强,只需证明酸性 H2SO4>H2CO3即可,可利用复分解反应中强酸制弱酸的原理,即可利用H2SO4+Na2CO3 |

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
装修材料中常用作红色颜料的有三氧化二铁和氧化亚铜.某学生想通过实验探究一红色粉末是Fe2O3、Cu2O或二者混合物.其探究过程如下:
查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3;
假设2:红色粉末是Cu2O;
假设3:______.
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂.
(1)若假设1成立,则实验现象是______.
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是______.
(3)另一同学欲用加热法确定粉末的组成.取72g固体粉末在空气中充分加热,待质量不再变化时,称其质量为80g,则原固体粉末是______.
结论:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲利用该红色粉末制取纯净的胆矾(CuSO4?5H2O).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
①试剂1为______,试剂2为______(选填字母A、B、C、D).
②固体x的化学式为______.