��Ŀ����
�״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO(g)+2H2(g) CH3OH(g) ��H1=��116 kJ��mol��1
CH3OH(g) ��H1=��116 kJ��mol��1
��1�������й�������Ӧ��˵����ȷ����________��
a�����¡����������£������ڵ�ѹǿ�������仯����淴Ӧ�ﵽƽ��
b��һ�������£�H2������������CO���������ʵ�2��ʱ���淴Ӧ�ﵽƽ��
c����������������䣬�����¶ȿ����CO��ת����
d��ʹ�ú��ʵĴ��������̴ﵽƽ���ʱ�䲢���CH3OH�IJ���
��2�����ݻ�Ϊ1L�ĺ��������У��ֱ��о���230�桢250�桢270�������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ1mol����COƽ��ת���ʵĹ�ϵ��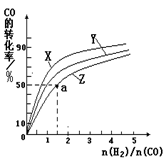
�������������¶��У�����Z��Ӧ���¶��� ��
������ͼ��a���Ӧ�����ݣ�����÷�Ӧ�ڶ�Ӧ�¶��µ�ƽ�ⳣ��K ��д��������̣���
���ڴ����Ӧλ���ϻ�����������Ӧ�ﵽƽ���С��ϵѹǿ���ﵽ�µ�ƽ������У����淴Ӧ������ʱ��ı仯��ϵͼ����ע��
��3����֪��CO(g)+ O2(g)=CO2(g) ��H2=��283 kJ��mol��1
O2(g)=CO2(g) ��H2=��283 kJ��mol��1
H2(g)+ O2(g)=H2O(g) ��H3=��242 kJ��mol��1
O2(g)=H2O(g) ��H3=��242 kJ��mol��1
���ʾ1mol��̬�״���ȫȼ������CO 2��ˮ����ʱ���Ȼ�ѧ����ʽΪ ��
��16�֣�
��1����a��2�֣�
�ڣ�5�֣��⣺����ͼ���֪CO��ת����Ϊ50%��H2�����ʵ���Ϊ1.5mol����
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
����ֵ���ʼŨ��/ mol��L��1 1 1.5 0
����ֵı仯Ũ��/ mol��L��1 0.5 1 0.5
����ֵ�ƽ��Ũ��/ mol��L��1 0.5 0.5 0.5��2�֣�
K=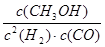 =
=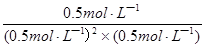 =4L2?mol��2
=4L2?mol��2
��3�֣�K�ı���ʽ���������ݡ������1�֣�������λ���۷֣�
��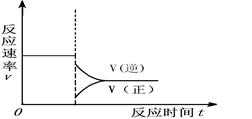
��4�֣����������ֵ㣺���淴Ӧ���ʱ仯������ȷ�����ұ�ע��ȷ����2�֣�������������ƽ̨���ע3Ҫ�أ�3����ȷ��2�֣�2����ȷ��1�֣�1����ȷ��0�֡�����������Ӧ���ʱ仯������ȷ�����ұ�ע��ȷ����2�֣�������������ƽ̨���ע3Ҫ�أ�3����ȷ��2�֣�2����ȷ��1�֣�1����ȷ��0�֡���
��3��CH3OH(g)+3/2O2(g)  CO2(g)+2H2O(g) ��H=��651kJ?mol��1
CO2(g)+2H2O(g) ��H=��651kJ?mol��1
��3�֣�����ʽ��״̬��ȷ1�֡���Ӧ��2�֣���λ��©��1�֣�
���������������1������CO(g)+2H2(g) CH3OH(g)������Ӧ���������ʵ�����С�ķ������ŷ�Ӧ��������У������������ܵ����ʵ�����С����˺��¡����������£������ڵ�ѹǿ��С����ѹǿ���ٱ仯��˵�������������ܵ����ʵ������ֲ��䣬��Ӧ�ﵽƽ�⣬��a��ȷ���������������ʺ�CO���������ʶ�������Ӧ���ʣ�����֮��ʼ�յ���ϵ��֮�ȣ�ȱ���淴Ӧ���ʣ���b����CO(g)+2H2(g)
CH3OH(g)������Ӧ���������ʵ�����С�ķ������ŷ�Ӧ��������У������������ܵ����ʵ�����С����˺��¡����������£������ڵ�ѹǿ��С����ѹǿ���ٱ仯��˵�������������ܵ����ʵ������ֲ��䣬��Ӧ�ﵽƽ�⣬��a��ȷ���������������ʺ�CO���������ʶ�������Ӧ���ʣ�����֮��ʼ�յ���ϵ��֮�ȣ�ȱ���淴Ӧ���ʣ���b����CO(g)+2H2(g) CH3OH(g)����H1=��116 kJ��mol��1��˵������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������Ȼ��淴Ӧ�����ƶ�����CO��ת���ʼ�С����c������������ʹƽ���ƶ������Լӿ췴Ӧ���ʣ����ʹ�ô��������̴ﵽƽ���ʱ�䣬���Dz������CH3OH�IJ�������d������2���ٺϳɼ״������Ƿ��ȷ�Ӧ�������¶�ƽ�������Ȼ��淴Ӧ�����ƶ���CO��ƽ��ת���ʼ�С����CO��ת����ԽС����Ӧ�¶�Խ�ߣ�ͼ��n(H2)/n(CO)���ֲ���ʱ��CO��ƽ��ת���ʣ�X>Y>Z��������Z��Ӧ���¶���270�棻�ڶ�ͼ�ɵã�a��ĺ�����n(H2)/n(CO)=1.5��������CO��ƽ��ת����Ϊ50%������ʼʱn(CO)=1mol����n(H2)=1.5mol����
CH3OH(g)����H1=��116 kJ��mol��1��˵������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������Ȼ��淴Ӧ�����ƶ�����CO��ת���ʼ�С����c������������ʹƽ���ƶ������Լӿ췴Ӧ���ʣ����ʹ�ô��������̴ﵽƽ���ʱ�䣬���Dz������CH3OH�IJ�������d������2���ٺϳɼ״������Ƿ��ȷ�Ӧ�������¶�ƽ�������Ȼ��淴Ӧ�����ƶ���CO��ƽ��ת���ʼ�С����CO��ת����ԽС����Ӧ�¶�Խ�ߣ�ͼ��n(H2)/n(CO)���ֲ���ʱ��CO��ƽ��ת���ʣ�X>Y>Z��������Z��Ӧ���¶���270�棻�ڶ�ͼ�ɵã�a��ĺ�����n(H2)/n(CO)=1.5��������CO��ƽ��ת����Ϊ50%������ʼʱn(CO)=1mol����n(H2)=1.5mol����
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
����ֵ���ʼŨ��/ mol��L��1 1 1.5 0
����ֵı仯Ũ��/ mol��L��1 0.5 1 0.5
����ֵ�ƽ��Ũ��/ mol��L��1 0.5 0.5 0.5
K=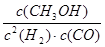 =
=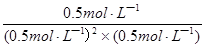 =4L2?mol��2
=4L2?mol��2
�ۻ�ͼҪ�㣺a������CO(g)+2H2(g) CH3OH(g)������Ӧ�����������С�ķ����������������С��ϵѹǿʱ��ƽ�����������������淴Ӧ�����ƶ������淴Ӧ���ʴ�������Ӧ���ʣ�b�����ڷ�Ӧ��������������������������С��������Ӧ���ʺ��淴Ӧ���ʾ����Լ�С��c���ﵽ��ƽ��֮ǰ���淴Ӧ������С������Ӧ������������Ϊƽ�����淴Ӧ�����ƶ���������Ũ����С����Ӧ��Ũ������������ԭƽ���С��d���ﵽ��ƽ��ʱ������Ӧ���ʺ��淴Ӧ������ȣ�������ԭƽ���С����3���Ƚ���֪�����Ȼ�ѧ����ʽ���Ϊ�٢ڢۣ��ٸ��ݸ�˹���ɣ��ɢ�+�ۡ�2���ٿɵã�CH3OH(g)+3/2O2(g)
CH3OH(g)������Ӧ�����������С�ķ����������������С��ϵѹǿʱ��ƽ�����������������淴Ӧ�����ƶ������淴Ӧ���ʴ�������Ӧ���ʣ�b�����ڷ�Ӧ��������������������������С��������Ӧ���ʺ��淴Ӧ���ʾ����Լ�С��c���ﵽ��ƽ��֮ǰ���淴Ӧ������С������Ӧ������������Ϊƽ�����淴Ӧ�����ƶ���������Ũ����С����Ӧ��Ũ������������ԭƽ���С��d���ﵽ��ƽ��ʱ������Ӧ���ʺ��淴Ӧ������ȣ�������ԭƽ���С����3���Ƚ���֪�����Ȼ�ѧ����ʽ���Ϊ�٢ڢۣ��ٸ��ݸ�˹���ɣ��ɢ�+�ۡ�2���ٿɵã�CH3OH(g)+3/2O2(g)  CO2(g)+2H2O(g) ��H=��651kJ?mol��1��
CO2(g)+2H2O(g) ��H=��651kJ?mol��1��
���㣺���黯ѧ��Ӧԭ�����漰��ѧƽ��ı�־�����������ƽ���ƶ���Ӱ�졢����ѧƽ�ⳣ���ļ��㡢���ȷ�Ӧ�����ȷ�Ӧ���¶ȶ�ƽ���ƶ���Ӱ�졢����ѹǿ�Է�Ӧ���ʺ�ƽ���ƶ���ͼ��˹���ɡ��Ȼ�ѧ����ʽ�ȡ�

������һ����ࡢ��Ч��������Դ��
I.�ü�����ȡ�����ķ�Ӧ��Ϊ�������������仯����ͼ��ʾ��
��1�������ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ�� ��
II.���ݻ�Ϊ1L���ܱ������ڣ�����0.1molCO��0.1molH2O���ڴ������ڵ������¸��¼���ʹ�䷴Ӧ�����CO2��Ũ����ʱ��仯��ͼ����ͼ��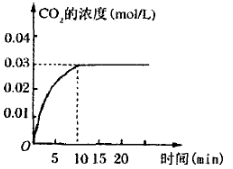
��2���ڸ��¶��£��ӷ�Ӧ��ʼ���ﵽƽ��ʱ��CO��ƽ����Ӧ����Ϊ ��
��3�����¶��£��˷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ�������÷�����ʾ�� ��
��4�����иı��У���ʹƽ��������Ӧ�����ƶ����� ��
| A�������¶� | B������ѹǿ |
| C������H2O��g����Ũ�� | D������CO2��g����Ũ�� |
�ϳɰ�Ȼ������������������Ҫ�Ļ���������
I����3��2 L���ܱ������У�����ͬ���¶��¡�ʹ����ͬ�Ĵ����ֱ���з�Ӧ��
3H2(g) + N2(g) 2NH3(g)������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ�й��������£�
2NH3(g)������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ�й��������£�
| �� | �� | �� | ||
| ��Ӧ��Ͷ���� | 3 mol H2��2 mol N2 | 6 mol H2��4mol N2 | 2 mol NH3 | ||
| �ﵽƽ���ʱ��/min | | 5 | 8 | ||
| ƽ��ʱN2��Ũ��/mol��L��1 | c1 | 1.5 | | ||
| NH3��������� | ��1 | | ��3 | ||
| ��������ܶ�/g��L��1 | ��1 | ��2 | |
��1���������з�Ӧ�ӿ�ʼ����ƽ��ķ�Ӧ����Ϊv(H2)=___________��
��2���ڸ��¶��¼������з�Ӧ��ƽ�ⳣ��K= (�ú�c1�Ĵ���ʽ��ʾ)��
��3�������ϱ����ݣ����й�ϵ��ȷ����________������ţ���
a��2c1 > 1.5 b��2��1 = ��2 c����3 = ��1
II����ҵ���ð����ϳ����أ�H2NCONH2���ķ�Ӧ�ڽ���ʱ��Ϊ����������
��һ����2NH3(l)��CO2(g)
 H2NCOONH4 (l) (���������) ��H1
H2NCOONH4 (l) (���������) ��H1�ڶ�����H2NCOONH4(l)
 H2O(l)��H2NCONH2(l) ��H2
H2O(l)��H2NCONH2(l) ��H2 ��4��ijʵ��С��ģ�ҵ�Ϻϳ����ص���������һ���Ϊ0.5 L�ܱ�������Ͷ��4 mol����1mol������̼��ʵ���÷�Ӧ�и������ʱ��ı仯������ͼI��ʾ��
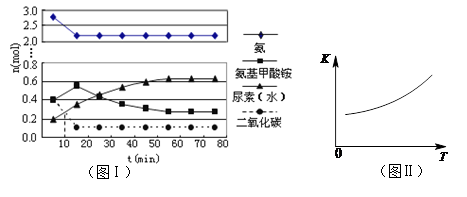
����֪�ܷ�Ӧ�Ŀ���������һ����������ϳ������ܷ�Ӧ�Ŀ����ɵ� ����Ӧ������
�ڵڶ�����Ӧ��ƽ�ⳣ��K���¶�T�ı仯������ͼII��ʾ�����H2 0��������һ����Ӧ����ʱ����Ũ����������ͼII�л�����һ����ӦK1���¶�T�仯���ߣ���������Ҫ�ı�ע��
��5������������Һ��������������ҵβ���е�NO��NO2������ת��ΪN2��
��������NO��NO2���ߵ����ʵ�����ӦΪ��CO(NH2)2+NO+NO2 =CO2+2N2+2H2O
�÷�Ӧ�е�������Ϊ ��д��ѧʽ����
����֪��N2(g)+O2(g)= 2NO(g) ��H ="a" kJ��mol��1
N2(g)+3H2(g)= 2NH3(g) ��H2="bkJ��" kJ��mol��1
2H2(g)+O2(g)= 2H2O(g) ��H=" c" kJ��mol��1
��4NH3(g) +4NO(g) +O2(g)= 4N2(g)+6H2O(g) ��H= ��
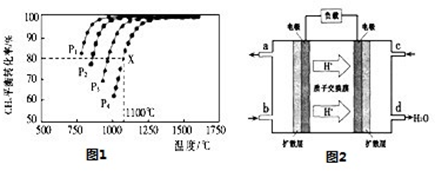
������ȼ�ϵ�ؽṹ����ͼ��ʾ���乤��ʱ�����缫��Ӧʽ�ɱ�ʾΪ ��
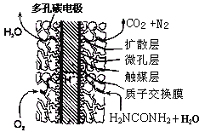
��������Ҫ�Ļ�����Ʒ֮һ��
��1���ϳɰ��õ��������Լ���Ϊԭ���Ƶá��йػ�ѧ��Ӧ�������仯����ͼ��ʾ��
��Ӧ�٢ڢ�Ϊ_________��Ӧ������ȡ����ȡ�����CH4(g)��H2O(g)��Ӧ����CO(g)��H2(g)���Ȼ�ѧ����ʽΪ__________________��
�� �� ��
��2���ð�����ȡ����[CO(NH2)2]�ķ�ӦΪ��2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)��
CO(NH2)2(l)+H2O(g)��
��ij�¶��£����ݻ�Ϊ10L���ܱ�������ͨ��2mol NH3��1molCO2����Ӧ�ﵽƽ��ʱCO2��ת����Ϊ50%���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=___________�����¶���ƽ�ⳣ��K�ļ�����Ϊ____________��
��Ϊ��һ�����CO2��ƽ��ת���ʣ����д�ʩ���ܴﵽĿ�ĵ���_____________
| A�����NH3��Ũ�� | B������ѹǿ |
| C����ʱת�����ɵ����� | D��ʹ�ø���Ч�Ĵ��� |
80��ʱ,2L�ܱ������г���0��40molN2O4,������Ӧ
N2O4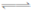 2NO2
2NO2 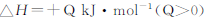 ,�����������:
,�����������: 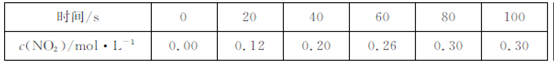 �����ж���ȷ����
�����ж���ȷ����
| A�������¶ȸ÷�Ӧ��ƽ�ⳣ��K��С |
B��20~40s��,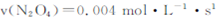 |
| C����Ӧ��ƽ��ʱ,���յ�����Ϊ0��30QkJ |
| D��100sʱ��ͨ��0��40molN2O4,����ƽ��ʱN2O4��ת�������� |
 CO2(g)+H2(g) ������ӦΪ���ȷ�Ӧ��������Ӧ�ﵽƽ��ʱ����������и����ʵ����ʵ�����Ϊ n mol����ʹH2�����ʵ���Ũ������1������������������ʱ�����д�ʩ�ɲ��õ��ǣ� ��
CO2(g)+H2(g) ������ӦΪ���ȷ�Ӧ��������Ӧ�ﵽƽ��ʱ����������и����ʵ����ʵ�����Ϊ n mol����ʹH2�����ʵ���Ũ������1������������������ʱ�����д�ʩ�ɲ��õ��ǣ� ��