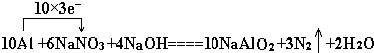题目内容
3.硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO44-四面体;如图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为SiO32-.

分析 (1)Si原子核外电子数为14,基态原子核外电子排布为1s22s22p63s23p2,据此解答;
(2)硅在自然界中,无游离态,以化合态存在;
(3)硅晶体和金刚石晶体类似都属于原子晶体,硅原子之间以共价键结合.在金刚石晶体的晶胞中,每个面心有一个碳原子(晶体硅类似结构),则面心位置贡献的原子为 6×$\frac{1}{2}$=3个;
(4)Mg2Si和NH4Cl在液氨介质中反应制得SiH4、NH3和MgCl2;
(5)①键能越小,化学键越不稳定;
②键能越小,化学键越不稳定,反应倾向于形成稳定性更强方向进行;
(6)硅酸盐中的硅酸根(SiO44-)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;根据图(b)的一个结构单元中含有1个硅、3个氧原子,化学式为SiO32-;3)Mg2Si和NH4Cl在液氨介质中反应制得SiH4、NH3和MgCl2.
解答 解:(1)Si原子核外电子数为14,基态原子核外电子排布为1s22s22p63s23p2,电子占据的最高能层符号为M,该能层具有的原子轨道数为1+3+5=9、电子数为4,
故答案为:M;9;4;
(2)硅主要以硅酸盐、二氧化硅等形式存在,故答案为:二氧化硅;
(3))硅晶体和金刚石晶体类似都属于原子晶体,硅原子之间以共价键结合.在金刚石晶体的晶胞中,每个面心有一个碳原子(晶体硅类似结构),则面心位置贡献的原子为 6×$\frac{1}{2}$=3个;
故答案为:共价键;3;
(4)Mg2Si和NH4Cl在液氨介质中反应制得SiH4、NH3和MgCl2,化学方程式:Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2;
故答案为:Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2;
(5)①由表中数据可知,C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成,
故答案为:C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成;
②由表中数据可知,C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键,
故答案为:C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键;
(6)硅酸盐中的硅酸根(SiO44-)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;
根据图(b)的一个结构单元中含有1个硅、3个氧原子,化学式为SiO32-;
故答案为:sp3;1:3;SiO32-.
点评 本题主要考查了基态原子的核外电子排布、晶体结构、化学方程式的书写、杂化轨道、化学键等知识,题目难度中等,注意键能对物质性质及结构的影响.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案| A. | CaCl2 和Ca(ClO)2 | B. | Ca(ClO)2 | C. | CaCl2 | D. | CaCO3 |
| A. | 石油裂解的主要目的是提高轻质液体燃料的产量 | |
| B. | 电解饱和食盐水制造烧碱时,采用离子交换膜可防止氯气进入阴极室 | |
| C. | 硫酸工业中在接触室安装热交换器的目的是利用SO2催化氧化时放出的热量 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
| A. | FeO与稀硝酸反应:FeO+2H+═Fe2++H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2 Br2+6Cl- | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
| A. | 该温度高于25℃ | |
| B. | 由水电离出来的H+的浓度是1.0×10-10mol/L | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | 该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性 |
 A、B、C、D均是由短周期元素形成的四种气体单质,E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去):
A、B、C、D均是由短周期元素形成的四种气体单质,E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去): PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2(R、R′代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%.
PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2(R、R′代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%. .
. +nHOCH2CH2OH$\stackrel{一定条件下}{→}$
+nHOCH2CH2OH$\stackrel{一定条件下}{→}$ +2nH2O.
+2nH2O.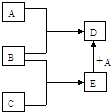 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).已知:
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).已知: