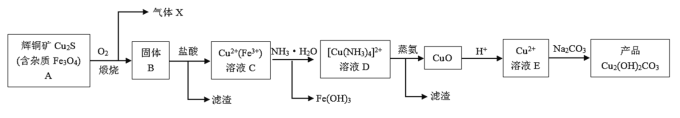
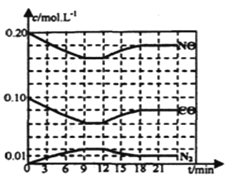
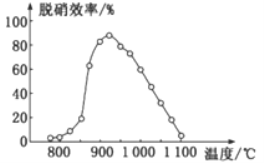
题目内容
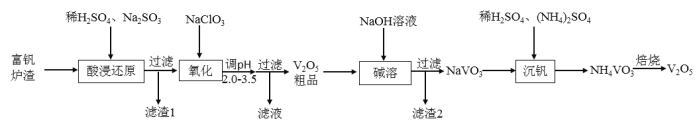
【题目】![]() 是接触法生产硫酸的催化剂,属于两性氧化物,可从富钒炉渣(主要含有
是接触法生产硫酸的催化剂,属于两性氧化物,可从富钒炉渣(主要含有![]() 、
、![]() 和少量
和少量![]() 、
、![]() )中提取,其工艺流程如下:
)中提取,其工艺流程如下:
已知:①![]()
②一些金属阳离子沉淀的pH范围:
开始沉淀pH | 完全沉淀pH | |
| 6.5 | 9.0 |
| 2.2 | 3.5 |
| 4.1 | 5.4 |
(1)“酸浸还原”时![]() 转化为
转化为![]() ,写出有关
,写出有关![]() 反应的离子方程式________;经“氧化”后钒以
反应的离子方程式________;经“氧化”后钒以![]() 存在,写出生成
存在,写出生成![]() 反应的离子方程式________。
反应的离子方程式________。
(2)调节溶液![]() 至2.0~3.5,宜选用的试剂是________(填标号)。/span>
至2.0~3.5,宜选用的试剂是________(填标号)。/span>
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(3)“滤渣1”的主要成分是________;![]() 粗品中的杂质为________。
粗品中的杂质为________。
(4)“沉钒”时需加入稀![]() ,其目的是________。
,其目的是________。
(5)焙烧产生的气体用________吸收后,其产物可以在该工艺中循环利用。
(6)![]() 在一定条件下可转化为不同价态的钒离子(
在一定条件下可转化为不同价态的钒离子(![]() 、
、![]() 、
、![]() 、
、![]() ),可作为全钒液充电流电池的电极液,电池总反应为
),可作为全钒液充电流电池的电极液,电池总反应为![]() 。下图是钒电池基本工作原理示意图:
。下图是钒电池基本工作原理示意图:
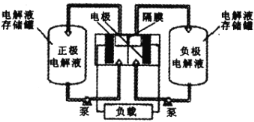
充电时阳极的反应式为____;能够通过钒电池基本工作原理示意图中“隔膜”的离子是_____。
【答案】![]()
![]() C
C ![]()
![]() 使
使![]() 的水解平衡逆向移动,增大
的水解平衡逆向移动,增大![]() 浓度,从而增大
浓度,从而增大![]() 的产量 稀
的产量 稀![]()
![]()
![]()
【解析】
富钒炉渣(主要含有![]() 、
、![]() 和少量
和少量![]() 、
、![]() )加稀硫酸将金属氧化物溶解得到硫酸亚铁和硫酸铝,加亚硫酸钠将
)加稀硫酸将金属氧化物溶解得到硫酸亚铁和硫酸铝,加亚硫酸钠将![]() 还原成
还原成![]() ,二氧化硅不溶解,过滤除去;滤液中加氯酸钠将
,二氧化硅不溶解,过滤除去;滤液中加氯酸钠将![]() 氧化成
氧化成![]() ,调节pH值后得到
,调节pH值后得到![]() 粗品;将粗品
粗品;将粗品![]() 溶于氢氧化钠溶液中得到
溶于氢氧化钠溶液中得到![]() 溶液,过滤杂质,在滤液中加稀硫酸和硫酸铵得到
溶液,过滤杂质,在滤液中加稀硫酸和硫酸铵得到![]() ,焙烧得纯净的
,焙烧得纯净的![]() ,据此分析解答。
,据此分析解答。
(1)“酸浸还原”时![]() 转化为
转化为![]() ,离子方程式为
,离子方程式为![]() ,加氯酸钠将
,加氯酸钠将![]() 氧化成
氧化成![]() ,相应的离子反应方程式为:
,相应的离子反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)调节溶液![]() 至2.0~3.5,使
至2.0~3.5,使![]() 平衡正向移动得到
平衡正向移动得到![]() ,需加碱性溶液中和氢离子,A、B为酸溶液不能与氢离子反应,故不合题意;D氢氧化钙能中和氢离子但会引入钙离子杂质,故不合题意,碳酸钠既可以中和氢离子又不引入新的杂质离子,故选择C,故答案为:C;
,需加碱性溶液中和氢离子,A、B为酸溶液不能与氢离子反应,故不合题意;D氢氧化钙能中和氢离子但会引入钙离子杂质,故不合题意,碳酸钠既可以中和氢离子又不引入新的杂质离子,故选择C,故答案为:C;
(3) “滤渣1”的主要成分是不溶于硫酸的二氧化硅;加硫酸溶解过滤后的滤液中存在亚铁离子,加氯酸钠后被氧化成三价铁离子,调节溶液![]() 至2.0~3.5时三价铁离子转变成
至2.0~3.5时三价铁离子转变成![]() 沉淀,因此
沉淀,因此![]() 粗品中含有
粗品中含有![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(4) 因铵根离子会发生水解反应,导致其溶液中的铵根离子浓度减小,而加稀硫酸后可以使![]() 的水解平衡逆向移动,增大
的水解平衡逆向移动,增大![]() 浓度,从而增大
浓度,从而增大![]() 的产量,故答案为:使
的产量,故答案为:使![]() 的水解平衡逆向移动,增大
的水解平衡逆向移动,增大![]() 浓度,从而增大
浓度,从而增大![]() 的产量;
的产量;
(5)焙烧过程中![]() 分解产生氨气和
分解产生氨气和![]() ,产生的氨气可以用稀硫酸吸收转变成硫酸铵在沉钒时循环使用,故答案为:稀
,产生的氨气可以用稀硫酸吸收转变成硫酸铵在沉钒时循环使用,故答案为:稀![]() ;
;
(6)充电时阳极发生氧化反应,结合总反应式可得阳极电极反应为:![]() ,由阳极反应可知电解过程中阳极区的氢离子浓度增大,为维持两侧溶液的电荷守恒,氢离子应透过隔膜向阴极移动,故答案为:
,由阳极反应可知电解过程中阳极区的氢离子浓度增大,为维持两侧溶液的电荷守恒,氢离子应透过隔膜向阴极移动,故答案为:![]() ;
;![]() ;
;

【题目】闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
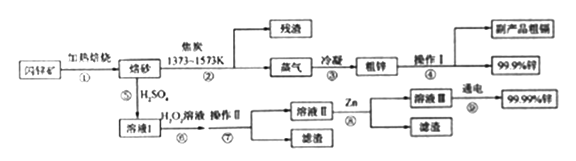
已知:
(I)相关金属单质的熔沸点
金属单质 | Zn | Fe | Cu | Cd |
熔点(K) | 693 | 1812 | 1356 | 594 |
沸点(K) | 1180 | 3023 | 2840 | 1040 |
(II)几种离子生成氢氧化物沉淀的pH
开始沉淀pH | 完全沉淀 pH | |
Fe3+ | l.l | 3.2 |
Zn2+ | 5.9 | 8.9 |
Cu2+ | 4.7 | 6.7 |
Cd2+ | 6.9 | 9.6 |
请回答下列问题:
(1)写出步骤①发生的主要反应的化学方程式___________________。
(2)步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收akJ的热量,请写出该反应的热化学方程示________________。
(3)步骤④中操作I的分离方法为_______,得到副产品粗 镉需控制温度为_____左右。
(4)步骤⑦需调节溶液pH为_______,目的是__________。
(5)步骤⑨以Pt为阳极、Al为阴极进行电解的化学方程式为__________。
(6)分别取闪锌矿200kg,通过火法炼锌得到Zn的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为________。
【题目】四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
W | X | Y | Z | |
结构 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元 | 最高正价与最 |
(1)Z在元素周期表中位于 族。
(2)上述元素的最高价氧化物对应的四种水化物中,有一种物质在一定条件下均能与其它三种物质发生化学反应,该元素是 (填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是 (填序号)。
A.自然界中的含量 B.相应氯化物水溶液的pH
C.单质与水反应的难易程度 D.单质与酸反应时失去的电子数
②W、X、Y的离子半径由大到小的顺序为 。(填对应的离子符号)
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是 ,混合后溶液中离子浓度由大到小的顺序是 。
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。

能确定混合物中Y的质量分数的数据有 (填序号)。
A.m、n B.m、y C.n、y