题目内容
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和.
(1)A为 ,B为 ,C为 ,D为 .(填元素符号)
(2)D的最高价氧化物的水化物的化学式是 ,E的电子式是 .
(3)写出由A、B组成的化合物与E反应的化学方程式: .
(1)A为
(2)D的最高价氧化物的水化物的化学式是
(3)写出由A、B组成的化合物与E反应的化学方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,据此解答.
解答:
解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,
(1)由上述分析可知,A为C元素、B为O元素、C为Na元素、D为S元素,故答案为:C;O;Na;S;
(2)D为S元素,最高价氧化物的水化物的化学式是H2SO4,E为Na2O2,电子式是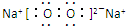 ,故答案为:H2SO4;
,故答案为:H2SO4;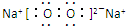 ;
;
(3)二氧化碳与过氧化钠反应生成碳酸钠与氧气,化学反应方程式为:2Na2O2+CO2=2Na2CO3+O2,
故答案为:2Na2O2+CO2=2Na2CO3+O2.
(1)由上述分析可知,A为C元素、B为O元素、C为Na元素、D为S元素,故答案为:C;O;Na;S;
(2)D为S元素,最高价氧化物的水化物的化学式是H2SO4,E为Na2O2,电子式是
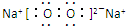 ,故答案为:H2SO4;
,故答案为:H2SO4;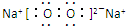 ;
;(3)二氧化碳与过氧化钠反应生成碳酸钠与氧气,化学反应方程式为:2Na2O2+CO2=2Na2CO3+O2,
故答案为:2Na2O2+CO2=2Na2CO3+O2.
点评:本题考查结构性质位置关系应用,侧重对化学用语的考查,比较基础,注意对基础知识的积累掌握.

练习册系列答案
相关题目
下列说法正确的是( )
| A、同种元素组成的物质一定是单质 |
| B、金属氧化物一定是碱性氧化物 |
| C、碱性氧化物一定是金属氧化物 |
| D、非金属氧化物一定是酸性氧化物 |
下列叙述正确的是( )
| A、需要加热的化学反应都是吸热反应 |
| B、热化学方程式中各物质前的化学计量数不表示分子数 |
| C、在101KPa时1mol物质燃烧时的反应热叫做该物质的燃烧热 |
| D、如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应时放热反应 |
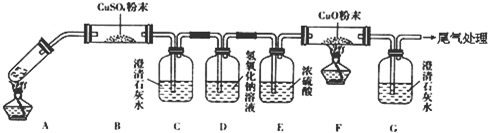
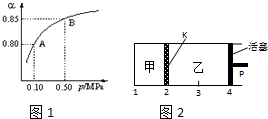 硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.
硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.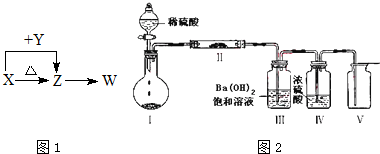
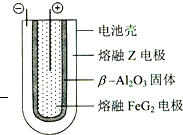 X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体.请回答下列问题(涉及物质均用化学式表示).
X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体.请回答下列问题(涉及物质均用化学式表示).