��Ŀ����
����Ŀ��������ԭ��Ӧ�������������о��й㷺����;��
��1�����������������е�������û�з���������ԭ��Ӧ����_____��ѡ��������
a. ��ˮ���� b. ��ҵ���ȼ� c. ��ˮɹ�� d. �������
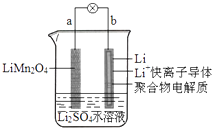
��2��ˮ���������Ҫ��ɲ������������к�������һ�������������ֻ�����Ӧ������������ԭ��Ӧ�Ĺ���������ͼ��ʾ��

��д����ˮ�μ��ҷ��Ϸ�Ӧ���� IV ��һ����ѧ����ʽ��___________________��
��3����ҵ������NaIO3��NaHSO3��Ӧ����ȡ����I2��
����ƽ���л�ѧ����ʽ����������ת�Ƶķ������Ŀ��
_____NaIO3+ NaHSO3�� I2+ Na2SO4+ H2SO4+ H2O
���÷�Ӧ��ԭ����_____��_____Ԫ�ر���ԭ�������� 1mol ����������ת�Ƶ�����ĿΪ_____NA��
��4����֪��HSO3-��I2��I-��SO42-��һЩδ֪����ɵ�һ��������ԭ��Ӧ������SO42-����������÷�Ӧ�л�ԭ��HSO3-_____I-������������������������ɸ÷�Ӧ_____________________________________��
���𰸡� c 2F2+2H2O��4HF+O2��2Na+2H2O��2NaOH+H2����C+H2O![]() CO+H2
CO+H2 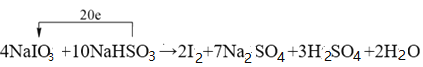 NaHSO3 I 2 �� H2O + I2+ HSO3����2I��+ SO42��+ 3H+
NaHSO3 I 2 �� H2O + I2+ HSO3����2I��+ SO42��+ 3H+
����������1��������Ԫ�ػ��ϼ������ķ�Ӧ����������ԭ��Ӧ������ѡ��ABD�ж��漰������ԭ��Ӧ��ѡ��C�������仯��һ������������ԭ��Ӧ����ѡC����2�����������ֻ�����Ӧ������������ԭ��Ӧ�Ĺ�ϵ��ͼ��֪�������û���Ӧ����˷��������Ŀ�����2F2+2H2O��4HF+O2 �� 2Na+2H2O��2NaOH+H2���� C+H2O![]() CO+H2����3������ѧ��Ӧ�е�Ԫ�ػ��ϼ۴�+5�۽�Ϊ0�ۣ�����1mol�ⵥ�ʹ�����10�ۣ���Ԫ�صĻ��ϼ۴�+4�����ߵ�+6�ۣ�2molNaHSO3����1molNa2SO4��������4�ۣ����ݵ����غ��ԭ���غ㣬������Ƶ�ǰ��ϵ����4�����������Ƶ�ϵ����10����4NaIO3+10NaHSO3=2I2+7Na2SO4+3H2SO4+2H2O����Ӧ������2mol�ⵥ��ת��20mol���������ʴ�Ϊ��
CO+H2����3������ѧ��Ӧ�е�Ԫ�ػ��ϼ۴�+5�۽�Ϊ0�ۣ�����1mol�ⵥ�ʹ�����10�ۣ���Ԫ�صĻ��ϼ۴�+4�����ߵ�+6�ۣ�2molNaHSO3����1molNa2SO4��������4�ۣ����ݵ����غ��ԭ���غ㣬������Ƶ�ǰ��ϵ����4�����������Ƶ�ϵ����10����4NaIO3+10NaHSO3=2I2+7Na2SO4+3H2SO4+2H2O����Ӧ������2mol�ⵥ��ת��20mol���������ʴ�Ϊ��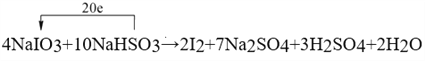 ������Ԫ�صĻ��ϼ����ߣ�����NaHSO3��������Ϊ��ԭ������������Ϊ�����ƺ�������IԪ�صĻ��ϼ۽��ͱ���ԭ�������� 1mol ����������ת�Ƶ�����ĿΪ
������Ԫ�صĻ��ϼ����ߣ�����NaHSO3��������Ϊ��ԭ������������Ϊ�����ƺ�������IԪ�صĻ��ϼ۽��ͱ���ԭ�������� 1mol ����������ת�Ƶ�����ĿΪ![]() ��NA=2NA����4����֪��HSO3-��I2��I-��SO42-��һЩδ֪����ɵ�һ��������ԭ��Ӧ������SO42-�����������HSO3-�ǻ�ԭ������Ԫ�ػ��ϼ����ߣ����Ԫ�ػ��ϼ۽��ͣ�I2Ϊ��������I-Ϊ��ԭ�����ѧ��Ӧ�л�ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ�����Ӧ�л�ԭ��HSO3-��I-���ٽ��������ԭ��Ӧ��ƽԭ����ƽ���÷�ӦΪ��H2O + I2 + HSO3��=2I��+ SO42��+ 3H+��
��NA=2NA����4����֪��HSO3-��I2��I-��SO42-��һЩδ֪����ɵ�һ��������ԭ��Ӧ������SO42-�����������HSO3-�ǻ�ԭ������Ԫ�ػ��ϼ����ߣ����Ԫ�ػ��ϼ۽��ͣ�I2Ϊ��������I-Ϊ��ԭ�����ѧ��Ӧ�л�ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ�����Ӧ�л�ԭ��HSO3-��I-���ٽ��������ԭ��Ӧ��ƽԭ����ƽ���÷�ӦΪ��H2O + I2 + HSO3��=2I��+ SO42��+ 3H+��

 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�