题目内容
【题目】标准状况下,将![]() 气体通入aLbmo
气体通入aLbmo![]() 的NaOH溶液中,下列对所得溶液的描述不正确的是
的NaOH溶液中,下列对所得溶液的描述不正确的是![]()
A. 随着
随着 ![]() 气体的通入,溶液中由水电离出的
气体的通入,溶液中由水电离出的![]() 有如图变化关系
有如图变化关系
B.当![]() b时,所得溶液中存在:
b时,所得溶液中存在:![]()
C.当![]() b时,所得溶液中存在:
b时,所得溶液中存在:![]()
![]()
D.当![]()
![]() 时,所得溶液中一定存在:
时,所得溶液中一定存在:![]()
【答案】D
【解析】
当![]() :
:![]() 时,发生反应
时,发生反应![]() ,当
,当![]() :
:![]() 时,发生反应
时,发生反应![]() ,当
,当![]() :
:![]() 时,
时,
A.随着硫化氢的通入,反应![]() 发生,硫化钠促进水电解,但反应
发生,硫化钠促进水电解,但反应![]() 发生时,由于生成NaHS的水解能力小于硫化钠的水解能力,导致由水电离产生氢离子浓度有所降低,反应
发生时,由于生成NaHS的水解能力小于硫化钠的水解能力,导致由水电离产生氢离子浓度有所降低,反应![]() 发生完全后,硫化氢过量,由水电离产生的氢离子浓度降低更大,选项A正确;
发生完全后,硫化氢过量,由水电离产生的氢离子浓度降低更大,选项A正确;
B.当![]() b时,发生反应
b时,发生反应![]() ,溶液中的溶质是NaHS,根据物料守恒得
,溶液中的溶质是NaHS,根据物料守恒得![]() ,根据电荷守恒得
,根据电荷守恒得![]() ,所以得
,所以得![]() ,选项B正确;
,选项B正确;
C.当![]() b时,发生反应
b时,发生反应![]() ,溶液中的溶质是
,溶液中的溶质是![]() ,硫离子部分水解生成
,硫离子部分水解生成![]() ,硫离子两步水解都生成氢氧根离子,所以溶液呈碱性,且
,硫离子两步水解都生成氢氧根离子,所以溶液呈碱性,且![]() ,则离子浓度大小顺序为:
,则离子浓度大小顺序为:![]() ,选项C正确;
,选项C正确;
D.当![]()
![]() 时,
时,![]() 完全反应,
完全反应,![]() 部分反应,生成
部分反应,生成![]() 、NaHS,NaHS溶液中存在
、NaHS,NaHS溶液中存在![]() ,
,![]() 溶液中存在
溶液中存在![]() ,所以在
,所以在![]() 、NsHS混合溶液中不存在
、NsHS混合溶液中不存在![]() ,选项D错误;
,选项D错误;
答案选D。

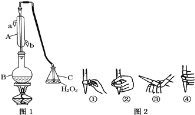
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、量筒、0.5mol·L-1盐酸、0.55mol·L-1NaOH溶液,实验尚缺少的玻璃用品是__。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒__(填“能”或“否”),其原因是__。
(3)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50mL0.55mol·L-1NaOH溶液 | 50mL0.5mol·L-1溶液 | 20℃ | 23.3℃ | |
② | 50mL0.55mol·L-1NaOH溶液 | 50mL0.5mol·L-1HCl溶液 | 20℃ | 23.5℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ·℃-1·kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。___
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:__。