题目内容
下列说法正确的是( )
| A.元素原子的最外层电子数等于元素的最高化合价 |
| B.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| C.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
| D.Na、Mg、Al失电子能力和最高价氧化物对应水化物的碱性均依次减弱 |
D
解析试题分析:主族元素原子的最外层电子数等于元素的最高化合价,但需要注意的是F没有正价,氧元素没有最高价,A不正确;多电子原子中,在离核较近的区域内运动的电子能量较低,B不正确;素周期表中位于金属和非金属分界线附近的元素一般既具有金属性,也具有非金属性,常用作半导体材料。副族和第Ⅷ族元素属于过渡元素,C不正确;Na、Mg、Al均属于第三周期元素,同周期自左向右,金属性逐渐减弱,最高价氧化物的碱性逐渐减弱,则选项D正确,答案选D。考点:考查化合价、核外电子排布、元素周期表的结构以及元素周期律的应用
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,注重对学生基础知识的巩固和检验,旨在培养学生的应试能力,提高学生的学习效率。该题的关键是熟练记住元素周期表的结构和元素周期律的应用。

 全优点练单元计划系列答案
全优点练单元计划系列答案下列有关物质性质的比较中,正确的是( )
①沸点:H2O>HCl>HF ②密度:四氯化碳>水>汽油
③酸性:H3PO4>H2SO4>HClO4 ④离子半径:O2->F->Na+
| A.①③ | B.②④ | C.①④ | D.②③ |
下列有关原子结构和元素周期律的表述,正确的是( )
①原子序数为16的元素的最高化合价为+4
②IA族元素是同周期中失电子能力最强的元素
③第2周期IVA族元素的原子核电荷数和中子数一定为6
④原子序数为13的元素位于元素周期表的第3周期III族
| A.①② | B.①③ | C.②④ | D.③④ |
下列排列顺序正确的是( )
① 热稳定性:H2O>HF>H2S ② 原子半径:Na>Mg>O
③ 酸性:H3PO4>H2SO4>HClO4 ④ 熔沸点:H2O>HF>HCl
| A.①③ | B.②④ | C.①④ | D.②③ |
1898年,IUPAC(International Union of Pure and Applied Chemistry,国际纯粹与应用化学联合会)建议用1~18列代替原周期表中主族、副族序号,请问原第IVA族应该在第几列?
| A.第4列 | B.第14列 |
| C.第5列 | D.第15列 |
(10分)A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
| A | | C |
| | B | |
(1)A、B、C三种元素的名称分别为 、 、 。
(2)B位于元素周期表中第 周期、第 族。
(3)C的原子结构示意图为 ,C的单质与
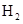 反应的化学方
反应的化学方 程式为 。
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式 。