题目内容
为除去粗盐中含有的Ca2+、Mg2+、Fe3+、![]() 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):称取粗盐
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):称取粗盐![]() 滤液
滤液![]()
![]() 精盐.
精盐.
(1)判断BaCl2已过量的方法是________.
(2)第④步中相关的离子方程式是________.
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是________.
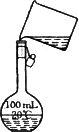
(4)为检验精盐纯度,需配制150 mL 0.2 mol·L-1 NaCl(精盐)溶液,如图是该同学转移溶液的示意图,图中的错误是________.
答案:
解析:
解析:
|
答案:(1)取第②步后的上层清液1~2滴于点滴板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,表明BaCl2已过量. (2)Ca2++ (3)先加HCl会有少量Mg(OH)2、Fe(OH)3、CaCO3、BaCO3溶解,从而影响制得精盐的纯度. (4)未用玻璃棒引流,未采用150 mL容量瓶. 解析:加入BaCl2、NaOH、Na2CO3等沉淀剂后,产生BaSO4、Fe(OH)3、Mg(OH)2、BaCO3、CaCO3沉淀,还有过量Na2CO3,需加入HCl使Na2CO3转变成NaCl.但若先加HCl再过滤,Mg(OH)2、Fe(OH)3、BaCO3、CaCO3都可能溶解,造成产品纯度不高. 评注:点滴板是一种用于试剂检测的仪器,其优点是使用方便,节约试剂(药品). |

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
 上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________, 上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,