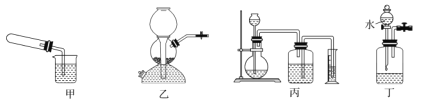
题目内容
【题目】 下列说法正确的是( )
A.室温下,反应NH3(g)+HCl(g)=NH4Cl(s)能自发发生反应,则该反应的△H<0
B.甲醇燃料电池工作时,甲醇得到电子,发生还原反应
C.常温下,0.1molL﹣1CH3COOH溶液加水稀释后,溶液中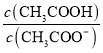 的值减小
的值减小
D.在Na2CO3溶液中加入少量Ca(OH)2固体,CO32﹣水解程度减小,溶液的pH减小
【答案】AC
【解析】
A、△H﹣T△S<0反应自发,反应NH3(g)+HCl(g)=NH4Cl(s)是熵减反应△S<0,只有放热反应△H<0才能使△H﹣T△S<0,故A正确;
B、甲醇燃料电池中,甲醇在负极失电子发生氧化反应,故B错误;
C、加水稀释促进电离,导致n(CH3COO﹣)增大,n(CH3COOH)减小,因此 =
= 减小,故C正确;
减小,故C正确;
D、Na2CO3溶液中加入少量Ca(OH)2固体,生成碳酸钙沉淀和NaOH,CO32﹣水解程度减小,但溶液的pH增大,故D错误。
答案选AC。

【题目】在Na+浓度为0.5mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+ Ag+ Mg2+ Ba2+ |
阴离子 | NO3- CO32- Cl- SO42- |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀硝酸 | 放出标准状况下0.56L无色气体 |
Ⅱ | 向Ⅰ的反应混合液中加入过量的硝酸钡,产生白色沉淀,对沉淀洗涤、干燥,称量所得固体质量 | 固体质量为9.32克 |
Ⅲ | 向Ⅱ的滤液中滴加硝酸银溶液 | 无明显现象 |
请回答下列问题。
(1)实验Ⅰ能确定一定不存在的离子是___。
(2)实验Ⅰ中生成气体的离子方程式为___。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。___
阴离子 | NO3- | CO32- | Cl- | SO42- |
c/mol·L-1 |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:___。