题目内容
化学平衡常数(K)、弱酸的电离常数(Ka)、难溶物的溶度积常数(KSP)是判断物质性质或变化的重要的平衡常数.下列关于这些常数的说法中,正确的是( )
| A.平衡常数的大小与温度、浓度、压强、催化剂等有关 |
| B.当温度升高时,弱酸的电离常数Ka变小 |
| C.KSP(AgCl)>KSP(AgI),由此可以判断AgCl(s)+I-=AgI(s)+Cl-能够发生 |
| D.Ka(HCN)<Ka(CH3COOH),说明相同物质的量浓度时,氢氰酸的酸性比醋酸强 |
A、平衡常数的大小与温度有关,与浓度、压强、催化剂等无关,故A错误;
B、弱电解质电离平衡是吸热过程;当温度升高时,弱酸的电离常数Ka变大,故B错误;
C、KSP(AgCl)>KSP(AgI),反应向更难溶的方向进行,AgCl(s)+I-=AgI(s)+Cl-能够发生,实现沉淀转化,故C正确;
D、Ka(HCN)<Ka(CH3COOH),说明相同物质的量浓度时,电离平衡常数越大酸性越强,所以氢氰酸的酸性比醋酸弱,故D错误;
故选C.
B、弱电解质电离平衡是吸热过程;当温度升高时,弱酸的电离常数Ka变大,故B错误;
C、KSP(AgCl)>KSP(AgI),反应向更难溶的方向进行,AgCl(s)+I-=AgI(s)+Cl-能够发生,实现沉淀转化,故C正确;
D、Ka(HCN)<Ka(CH3COOH),说明相同物质的量浓度时,电离平衡常数越大酸性越强,所以氢氰酸的酸性比醋酸弱,故D错误;
故选C.

练习册系列答案
相关题目
在一定条件下存在反应:I2(g)+H2(g)?2HI(g),其正反应放热.现有3个相同的2L恒容绝热(与外界没有热量交换)密闭容器甲、乙、丙,在甲中充入1mol I2(g)和1mol H2(g),在乙中充入2mol HI(g),在丙中充入2mol I2(g)和2mol H2(g),在一定温度下下开始反应.达到平衡时,下列说法不正确的是( )
| A、容器甲、丙中,逆反应的速率:v(甲)=v(丙) | B、容器甲、乙中,HI 的物质的量:n(甲)<n(乙) | C、容器甲、乙中有关反应物的转化率:α(H2)+α(HI)<100% | D、容器甲、乙中,化学平衡常数:K(甲)=K(乙) |
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.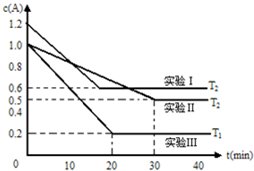 恒容体系,发生如下反应2A(g)?B(g)+xC(?)△H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
恒容体系,发生如下反应2A(g)?B(g)+xC(?)△H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):