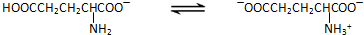题目内容
将一定体积的稀硝酸溶液平均分成两份,一份与足量的铜粉反应收集到气体的体积V1,另一份先加入与其等体积的稀硫酸,再投入足量的铜粉收集到的气体的体积为V2(V1,与V2都是在同一条件下测定).已则2V1=V2,则稀硝酸与稀硫酸的物质的量浓度之比为
- A.1:1
- B.2:1
- C.3:1
- D.任意比
B
分析:根据反应:3Cu+8H++2NO3-=3Cu2++2NO↑+H2O计算.
解答:第一份只有HNO3,发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+H2O,H+不足,溶液中剩余NO3-,设有8mol HNO3,
则生成2mol NO,消耗8mol H+;
另一份先加入与其等体积的稀硫酸,溶液中硫酸提供H+,2V1=V2,则应生成4molNO,根据3Cu+8H++2NO3-=3Cu2++2NO↑+H2O
可知消耗16mol H+,
所以硝酸与硫酸溶液中H+的物质的量相等,
则稀硝酸与稀硫酸的物质的量为2:1,
稀硝酸与稀硫酸的物质的量浓度之比为2:1,
故选B.
点评:本题考查混合物的计算,题目难度中等,注意根据反应的离子方程式计算.
分析:根据反应:3Cu+8H++2NO3-=3Cu2++2NO↑+H2O计算.
解答:第一份只有HNO3,发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+H2O,H+不足,溶液中剩余NO3-,设有8mol HNO3,
则生成2mol NO,消耗8mol H+;
另一份先加入与其等体积的稀硫酸,溶液中硫酸提供H+,2V1=V2,则应生成4molNO,根据3Cu+8H++2NO3-=3Cu2++2NO↑+H2O
可知消耗16mol H+,
所以硝酸与硫酸溶液中H+的物质的量相等,
则稀硝酸与稀硫酸的物质的量为2:1,
稀硝酸与稀硫酸的物质的量浓度之比为2:1,
故选B.
点评:本题考查混合物的计算,题目难度中等,注意根据反应的离子方程式计算.

练习册系列答案
相关题目
谷氨酸一钠盐是味精的主要成分,谷氨酸一钠盐在水溶液中存在如下平衡:
⑴当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。实验室中检验淀粉水解产物可选用的试剂是 。
| A.NaOH溶液、氨水、AgNO3溶液 | B.H2SO4溶液、氨水、AgNO3溶液 |
| C.NaOH溶液、CuSO4溶液 | D.H2SO4溶液、CuSO4溶液 |
将一定质量的味精样品溶于水,再向溶液中加入36%甲醛溶液,发生的反应如下:
R—NH2+HCHO→R—N=CH2+H2O(R表示除“-NH2”外的基团),再以酚酞为指示剂,用NaOH溶液进行滴定。
①上述测定过程中加入甲醛的目的是 。
②滴定终点的实验现象为 。
⑶味精中常含食盐,有两个同学分别设计甲、乙两种方案来测定味精中NaCl的含量。
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后, (填写操作步骤),称量沉淀质量。
②乙方案:取mg味精溶于水,加入过量浓度为c1mol·L—1的AgNO3溶液,再加入少量 溶液做指示剂,用浓度为c2mol·L—1的NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点。已知:AgSCN是难溶于水的沉淀。
设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1mL和V2mL,则该味精样品中NaCl的质量分数是 。
 晶体是质点(分子、离子、或原子)在空间有规则地排列的,具有整齐外形,以多面体出现的固体物质.在空间里无限地周期性的重复能成为晶体的具有代表性的最小单元,称为晶胞.一种Al-Fe合金的立体晶胞如图所示.
晶体是质点(分子、离子、或原子)在空间有规则地排列的,具有整齐外形,以多面体出现的固体物质.在空间里无限地周期性的重复能成为晶体的具有代表性的最小单元,称为晶胞.一种Al-Fe合金的立体晶胞如图所示.