��Ŀ����
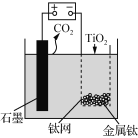
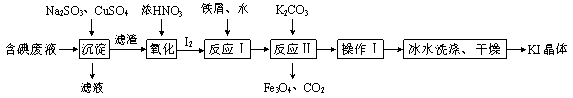
����Ŀ��һ�ֻ��ղ����ú�����I������Һ�Ĺ����������£�
��1����������������CuI�����ӷ���ʽΪ ��
��2��CuSO4��Ͷ�����Է�ˮ��I����ȥ����Ӱ��ϴ�ͬͶ�������ù���ϵ����ʾ���£���Ӧ��I����Cu2+��Ũ����ͼ��ʾ�������˵�CuSO4����ϵ��ӦΪ ������ԭ��___________��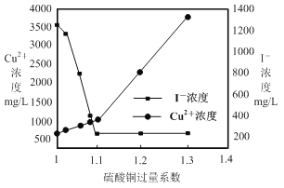
��3����Ӧ�������������Ļ�����������������������Ϊ21��127������Ӧ��Ļ�ѧ����ʽ��_________��
��4����������� ����ˮϴ�ӵ�Ŀ����_________��
���𰸡���1��2Cu2����2I����SO32����H2O = 2CuI����SO42����2H������2��1��1��С��1��1��I��ȥ���ʽϵ�������1��1�ֻ�����϶���ؽ�������Cu2������3��Fe3I8��4K2CO3 = Fe3O4��8KI��4CO2������4����������������Ũ��������������ȴ���ᾧ������ ����ȥ���������������ͬʱ����KI���ܽ���ʧ�����ֹKI����������
��������
�����������1�����ݳ����������ʣ�Cu2����SO32��������SO42������������ԭ��Cu����������ӷ�Ӧ����ʽ2Cu2����2I����SO32����H2O = 2CuI����SO42����2H������2��С��1��1��I��ȥ���ʽϵ�������1��1�ֻ�����϶���ؽ�������Cu2�������CuSO4����ϵ��Ϊ1��1����3�����⻯���������͵����ʵ���֮��21/56��127/127=3��8������������Fe3I8�����ݷ�ӦIIͶ�����ʺͲ����˷�Ӧ����ʽΪ��Fe3I8��4K2CO3 = Fe3O4��8KI��4CO2������4����������������Ũ��������������ȴ���ᾧ������ ����ˮϴ�ӵ�Ŀ���Ǽ���KI���ܽ⣬ͬʱϴȥ����������ʡ�

����Ŀ���״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ�Һ��ȼ�ϡ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
��ѧ��Ӧ | ƽ�ⳣ�� | �¶ȣ����� | |
500 | 800 | ||
��2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
��H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
��3H2(g)+ CO2(g) | K3 | ||
��1����Ӧ���� ��������������������������Ӧ��

��2��ij�¶��·�Ӧ����H2��ƽ��ת���ʣ�a������ϵ��ѹǿ(P)�Ĺ�ϵ��ͼ��ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K(A) K(B)����������������������=������
��3��500�� K3= ����Ӧ�ۡ�H 0������>����=������<����
��500����2L���ܱ������У����з�Ӧ�������ijʱ��H2��CO2��CH3OH��H2O�����ʵ����ֱ�Ϊ6mol��2 mol��10 mol��10 mol����ʱv(��) v(��)������>����=������<����

��4��һ���¶��£���3 L�ݻ��ɱ���ܱ������з�����Ӧ������֪c(CO)�뷴Ӧʱ��t�仯��������ͼ��ʾ������t0ʱ�̷ֱ�ı�һ����������������Ϊ��������������������������Ϊ������ʱ���ı�������� ������������Ϊ������span>ʱ���ı�������� ��