题目内容
将含有0.4mo l Cu(N03)2和0.3 mol KCl 的水溶液 1 L,用惰性电极电解一段时间后,在一个电极上析出 0.1 mol Cu ,此时要将溶液恢复到电解前溶液一样,可加入一定量的
l Cu(N03)2和0.3 mol KCl 的水溶液 1 L,用惰性电极电解一段时间后,在一个电极上析出 0.1 mol Cu ,此时要将溶液恢复到电解前溶液一样,可加入一定量的
 l Cu(N03)2和0.3 mol KCl 的水溶液 1 L,用惰性电极电解一段时间后,在一个电极上析出 0.1 mol Cu ,此时要将溶液恢复到电解前溶液一样,可加入一定量的
l Cu(N03)2和0.3 mol KCl 的水溶液 1 L,用惰性电极电解一段时间后,在一个电极上析出 0.1 mol Cu ,此时要将溶液恢复到电解前溶液一样,可加入一定量的| A.CuCl2 | B.CuO | C.Cu(OH)2 | D.CuCO3 |
A
略

练习册系列答案
相关题目
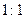 ,电解质可能为 。
,电解质可能为 。 H2放出,则电解质可能为 。
H2放出,则电解质可能为 。 Ni(CO)4(g) 该反应的ΔH ▲ 0 (选填“>”或“=”或“<”)。
Ni(CO)4(g) 该反应的ΔH ▲ 0 (选填“>”或“=”或“<”)。
 Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。
Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。 Cr3+
Cr3+ Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。 溶液时,图12-5所示的电解变化曲线合理的是
溶液时,图12-5所示的电解变化曲线合理的是
 标准状况)。已知:Au+HNO3+4HCl===H[AuCl4]+NO↑+2H2O。
标准状况)。已知:Au+HNO3+4HCl===H[AuCl4]+NO↑+2H2O。

 电的离子数目比为2:1,可供选择的电解液有下列四组,则符合题意的为哪一组?
电的离子数目比为2:1,可供选择的电解液有下列四组,则符合题意的为哪一组?