题目内容
A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道相等,若A元素的原子序数为a,则B元素原子序数不可能为
A.a+11 B.a-5 C.a+3 D.a+8
D
解析试题分析:A、B原子的最外层电子中成对电子和未成对电子占据的轨道数相等,则最外层电子数分别为3或6,前者各占据1个s轨道和1个p轨道,后者各占据2个s轨道和2个轨道,可能为B、O、Al、S等元素,原子序数分别为5、8、13、16,如A元素的原子序数为a,则B的原子序数可能为a+3、a+11、a-5,则只有a+8不可能,答案选D。
考点:考查原子结构与元素周期律知识

练习册系列答案
相关题目
类推是一种重要的学习方法,但如果不具体问题具体分析就会得出错误结论。下列类推结论正确的是
| A.SiH4的熔沸点比CH4高,则PH3的熔沸点比NH3高 |
| B.钠在空气中燃烧生成过氧化钠,则锂在空气中燃烧生成过氧化锂 |
| C.Al(OH)3能溶于NaOH溶液,则Be(OH)2能溶于NaOH溶液 |
| D.甲酸甲酯能发生银镜反应,则乙酸甲酯能发生银镜反应 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法不正确的是
| A.元素X与元素Z的最高正化合价之和的数值等于8 |
| B.Z的氧化物能与水反应 |
| C.离子Y2-和Z 3+的核外电子数和电子层数都相同 |
| D.元素Y的氢化物的稳定性比W的氢化物强 |
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
| A.非金属性:Z>T>X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R<T<Q |
| D.R、T、Q的最高正价相同 |
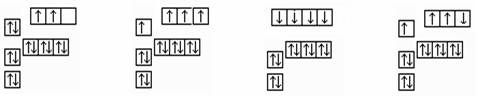
以下是一些原子的2p能级和3d能级中电子排布的情况。其中违反了洪特规则的是
| A.① | B.①③ | C.②④⑤ | D.③④⑤ |
若某一个原子在处于能量最低状态时,外围电子排布为4d15s2,则下列各项说法正确的是
| A.该元素原子最外层共有3个电子 |
| B.该元素位于第5周期ⅡA族 |
| C.该元素原子核外第N层上共有9个不同状态的电子 |
| D.该元素原子第四电子层上有5个空轨道 |
下列关于氢原子电子云图的说法正确的是
| A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大 |
| B.黑点密度大,单位体积内电子出现的机会大 |
| C.通常用小黑点来表示电子绕核作高速圆周运动 |
| D.电子云图是对电子运动无规律性的描述 |