题目内容
【题目】镁、硅及其化合物用途非常广泛。回答下列问题:
(1)基态Si原子价层电子的电子排布式为___,基态Mg原子电子占据最高能级的能层符号___。
(2)Mg2C3与CaC2的结构相似,与水反应可生成H2C=C=CH2,H2C=C=CH2端位碳原子的杂化方式是__,该反应所涉及的元素中电负性最小的是__(填元素符号),Mg2C3和H2C=C=CH2中均不存在___(填字母)。
A.σ键 B.配位键 C.氢键 D.π键
(3)晶格能又叫点阵能。它是1mol离子化合物中的正、负离子从相互分离的气态结合成离子晶体时所放出的能量。MgO晶格能可通过图1的BornHaber循环计算得到。
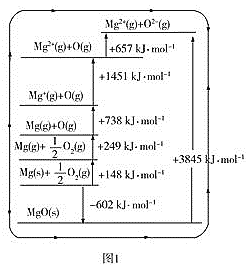
MgO的晶格能为___kJ·mol-1,O=O键的键能为__kJ·mol-1;Mg的第一电离能为___kJ·mol-1;
(4)Mg2Si晶胞结构如图2所示,已知其密度为1.84g·cm3,NA为阿伏加德罗常数的值。则晶胞参数a=__nm(列出计算式即可)。

【答案】3s23p2 M sp2 Mg BC 3845 498 738 
【解析】
(1)Si的原子序数是14,Mg的原子序数是12,根据核外电子排布式确定它们的价电子排布式;
(2)H2C=C=CH2端位碳原子,形成3个![]() 键,没有孤电子对;同一周期,从左到右,电负性依次增强,同一主族,从上到下电负性依次减弱;
键,没有孤电子对;同一周期,从左到右,电负性依次增强,同一主族,从上到下电负性依次减弱;
(3)Mg的第一电离能为气态Mg原子失去第一个电子时需要吸收的能量;由1molO2分子变成O原子的过程中,需要吸收的能量为(249×2)kJ;晶格能是气态离子形成1mol离子晶体释放的能量;
(6)Mg2Si晶胞结构如图2所示,利用均摊法找出晶胞中有8个Mg,有4个Si,然后进行相关计算,求出晶胞参数a。
(1)Si的原子序数是14,价电子排布式为3s23p2;Mg的原子序数是12,位于第三周期,故最高能层符号为M;
(2)H2C=C=CH2端位碳原子,形成3个![]() 键,没有孤电子对,故杂化类型为sp2,所涉及的元素中,电负性最小的是Mg;
键,没有孤电子对,故杂化类型为sp2,所涉及的元素中,电负性最小的是Mg;
A.Mg2C3中的C32-离子和H2C=C=CH2中均存在σ键,A不符合题意;
B.Mg2C3和H2C=C=CH2中均不存在配位键,B符合题意;
C.Mg2C3和H2C=C=CH2中均不存在氢键,C符合题意;
D.Mg2C3中的C32-离子和H2C=C=CH2中均存在π键,D不符合题意;
答案选BC;
(3)结合图像,晶格能是气态离子形成1mol离子晶体释放的能量,MgO的晶格能为3845kJ·mol-1;由1molO2分子变成O原子的过程中,需要吸收的能量为(249×2)kJ=498kJ;Mg的第一电离能为气态Mg原子失去第一个电子时需要吸收的能量为738 kJ·mol-1;
(4)Mg2Si晶胞结构如图2所示,Mg在顶点、面心、棱上和体心,利用均摊法计算出晶胞中含有的Mg为:![]() =8,Si在晶胞内部,有4个,(a×10-7 )3×1.84×NA=24×8+28×4,a=
=8,Si在晶胞内部,有4个,(a×10-7 )3×1.84×NA=24×8+28×4,a= nm。
nm。