题目内容
16.实验室中需要11.2L(标准状况下)二氧化碳,现在用含碳酸钙90.0%的石灰石与足量的稀盐酸反应(该石灰石中的杂质不与稀盐酸反应),问:(1)至少需要含碳酸钙90.0%的石灰石多少克?
(2)生成的氯化钙的物质的量是多少?
(3)若现有5mol/L的盐酸,至少需要加入该盐酸的体积是多少?
分析 发生反应CaCO3+2HCl=CaCl2+H2O+CO2↑,设至少需要含碳酸钙90.0%的石灰石的质量为x,则碳酸钙质量为905x,设生成的氯化钙的物质的量y,根据方程式中定量关系计算.
解答 解:设至少需要含碳酸钙90.0%的石灰石的质量为x,生成的氯化钙的物质的量y,盐酸的物质的量为z,则
CaCO3+2HCl=CaCl2+H2O+CO2↑
100g 2mol 1mol 22.4L
90%x z y 11.2L
x=$\frac{100g×11.2L}{22.4L×90%}$=55.6g
y=$\frac{1mol×11.2L}{22.4L}$=0.5mol
z=$\frac{2mol×11.2L}{22.4L}$=1mol
V(HCl)=$\frac{1mol}{5mol/L}$=0.2L
答:(1)至少需要含碳酸钙90.0%的石灰石55.6g;
(2)生成的氯化钙的物质的量是0.5mol;
(3)若现有5mol/L的盐酸,至少需要加入该盐酸的体积是0.2L.
点评 本题考查化学方程式的有关计算,关键是理解方程式中各个物理量之间的关系,注意左右单位不一致时,应左右单位相当,上下单位一致.

练习册系列答案
相关题目
18.下列离子方程式或热化学方程式正确的是( )
| A. | 在不同温度下,以相同浓度相同体积的Na2S2O3与H2SO4反应来探究温度对化学反应速率的影响: 3S2O32-+2SO42-+10 H+═6SO2↑+2S↓+5 H2O | |
| B. | 已知25℃、101 kPa时,1 mol H2与溴蒸气完全反应生成气态HBr放出能量Q kJ,其热化学方程式为H2(g)+Br2(g)═2HBr(g)△H=-2Q kJ•mol-1 | |
| C. | 表示中和热的热化学方程式:2HCl(aq)+Ba(OH)2(aq)═BaCl2(aq)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| D. | 酸性条件下,KI被O2氧化的离子方程式:4I-+O2+4H+=2I2+2H2O |
19.使溴水褪色,发生取代反应的是( )
| A. | CH2=CH2 | B. | HC≡CH | C. | C2H5OH | D. | 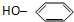 |
4.下列有机物属于芳香烃的是( )
①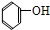 ②
②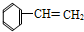 ③
③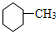 ④
④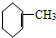 ⑤
⑤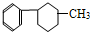 ⑥
⑥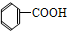 ⑦
⑦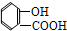 ⑧
⑧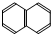 ⑨
⑨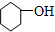 ⑩
⑩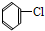
①
 ②
②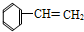 ③
③ ④
④ ⑤
⑤ ⑥
⑥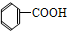 ⑦
⑦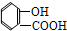 ⑧
⑧ ⑨
⑨ ⑩
⑩
| A. | ②③④⑤⑧⑩ | B. | ②⑤⑧ | C. | ③④⑧⑩ | D. | ②⑧⑩ |
11.下列各组内的物质属于同系物的是( )
| A. | CH3CH3 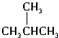 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH3 | |
| B. | CH3-CH3 CH2=CH-CH3 CH3CH=CHCH3 | |
| C. | 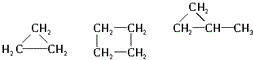 | |
| D. | CH3CH2CH2CH2CH3 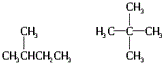 |
6.标准状况下VL HCl气体溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,溶
质的质量分数为ω,物质的量浓度为c mol/L,溶质的质量为mg,则下列关系中不正确的是( )
质的质量分数为ω,物质的量浓度为c mol/L,溶质的质量为mg,则下列关系中不正确的是( )
| A. | m=$\frac{36.5V}{22.4}$ | B. | ω=$\frac{36.5c}{1000ρ}$ | ||
| C. | c=$\frac{1000ρV}{36.5V+22400}$ | D. | c=$\frac{V}{22.4+22.4V}$ |
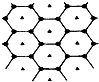 碳的一种单质石墨呈层状结构,有一碳镁新型材料就是在石墨碳原子层间加入镁原子层,两层俯视图:该材料的化学式为MgC2.
碳的一种单质石墨呈层状结构,有一碳镁新型材料就是在石墨碳原子层间加入镁原子层,两层俯视图:该材料的化学式为MgC2.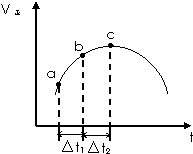 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.