��Ŀ����
����Ŀ��ijͬѧ��ͨ���Ƚ�����������Ӧ��ˮ���������ǿ������֤̼���ķǽ�����ǿ��������������ͼ��ʾ��װ�ý���ʵ�顣��ش��������⣺
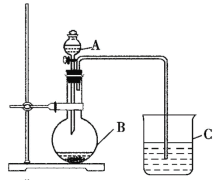
��1������B��������______��Ӧʢ������ҩƷ�е�______������ţ���
a��̼��� b�������� c���Ȼ��� d����������
��2������A��������______��Ӧʢ������ҩƷ�е�______������ţ���
a��ϡ���� b�������� c�������� d��ϡ����
��3������C��Ӧʢ�ŵ�ҩƷ��______��������______����ʵ����������֤��______�����Ա�______ǿ��______�ķǽ����Ա�______ǿ��
��4��B�з�����Ӧ�����ӷ���ʽΪ____________________��C�з�����Ӧ�����ӷ���ʽΪ_______________��
��5����һͬѧ��Ϊ��ʵ�����в���֮��������Ϊ����֮����__________________��
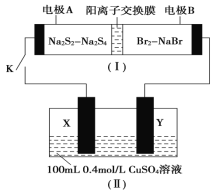
���𰸡�Բ����ƿ a ��Һ©�� d ��������Һ C���а�ɫ��״�������� ̼�� ���� C ![]()

 ������лӷ��ԣ����ܻ����C�У���ʵ���������
������лӷ��ԣ����ܻ����C�У���ʵ���������
��������
��ȻҪ�Ƚ�̼���ķǽ�����ǿ��������ͨ���Ƚ϶��ߵ�����������Ӧ��ˮ���������ǿ������˿�������ߵ�װ����ȡ![]() ���ұߵ�װ�÷�������Ƽ��ɡ�
���ұߵ�װ�÷�������Ƽ��ɡ�
��1��
����B��Բ����ƿ����ȻҪ��Һ����������![]() ����ôѡ��ϡ����+̼��ƱȽϺ��ʣ���ѡa��
����ôѡ��ϡ����+̼��ƱȽϺ��ʣ���ѡa��
��2������A�Ƿ�Һ©������װϡ���ᣬ��ѡd��
��3�����ݷ���������C��Ӧװ��������Һ��������C�в�����ɫ��״��������˵��![]() �����Ʒ�Ӧ�Ƶ���
�����Ʒ�Ӧ�Ƶ���![]() ����
����![]() ������ǿ��
������ǿ��![]() ����̼�ķǽ�����ǿ�ڹ裻
����̼�ķǽ�����ǿ�ڹ裻
��4��B�з���̼�����ϡ����ķ�Ӧ��д������ʽ![]() ��C�з����ķ�ӦΪ
��C�з����ķ�ӦΪ![]() ��
��
��5��������ܻӷ���������ӷ�����C��Ҳ�ܲ��������ɫ��������ʵ����ɸ��ţ���������B��C֮���һ��װ�б���ʳ��ˮ��ϴ��ƿ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�����в��ֶ�����Ԫ�ص������Ϣ���±���ʾ��
Ԫ�ش��� |
|
|
|
|
�����Ϣ | ��ˮ������������ߵ�Ԫ�� | ����⻯���ˮ��Һ�ʼ��� |
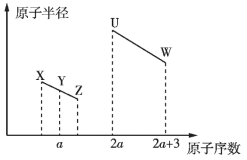
| ��������ǵ�3����Ԫ�صļ������а뾶��С�� |
��1��![]() ��Ԫ�����ڱ���λ�ڵ�______���ڵ�______�壻Ԫ��
��Ԫ�����ڱ���λ�ڵ�______���ڵ�______�壻Ԫ��![]() ��Ԫ��
��Ԫ��![]() ��ȣ������Խ�ǿ����______����Ԫ�ط��ű�ʾ����������֤����һ��ʵ����______������ţ���
��ȣ������Խ�ǿ����______����Ԫ�ط��ű�ʾ����������֤����һ��ʵ����______������ţ���
a��![]() ���ʵ��۵��
���ʵ��۵��![]() ���ʵĵ�
���ʵĵ�
b���ڻ�������![]() �Ļ��ϼ۱�
�Ļ��ϼ۱�![]() ��
��
c��![]() �ĵ���������ˮ���ҷ�Ӧ��
�ĵ���������ˮ���ҷ�Ӧ��![]() �ĵ��ʲ���
�ĵ��ʲ���
d��![]() ��
��![]() ͬ������
ͬ������![]() ��
��![]() ���Ҳ�
���Ҳ�
��2��![]() ��
��![]() Ԫ�ؿ��γɺ��й��ۼ��ij�����Ԫ���ӻ�����û�����Ļ�ѧʽΪ______���û����������Ӽ��빲�ۼ�����Ŀ��Ϊ______��
Ԫ�ؿ��γɺ��й��ۼ��ij�����Ԫ���ӻ�����û�����Ļ�ѧʽΪ______���û����������Ӽ��빲�ۼ�����Ŀ��Ϊ______��
��3��![]() ��
��![]() ���⻯��
���⻯��![]() ��
��![]() ��һ�������·�Ӧ�ɵõ�һ�ֵ��ʺ�һ�ֳ�����ΪҺ������ʣ���д���÷�Ӧ�Ļ�ѧ����ʽ��__________________________________________��
��һ�������·�Ӧ�ɵõ�һ�ֵ��ʺ�һ�ֳ�����ΪҺ������ʣ���д���÷�Ӧ�Ļ�ѧ����ʽ��__________________________________________��