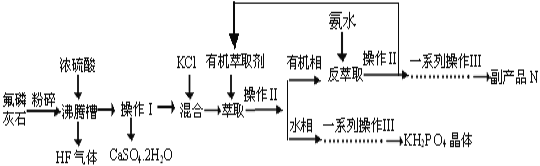
题目内容
【题目】工业废水中常含有一定量氧化性较强的Cr2O72-,利用滴定原理测定Cr2O72-含量方法如下:
步骤Ⅰ:量取30.00 mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应:Cr2O72-+6I-+14H+ === 2Cr3++3I2+7H2O。
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000 molL-1Na2S2O3溶液进行滴定,数据记录如下:(I2+2Na2S2O3 === 2NaI+Na2S4O6)
滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
笫一次 | 1.02 | 19.03 |
第二次 | 2.00 | 19.99 |
第三次 | 0. 20 | a |
(1)步骤Ⅰ量取30.00 mL废水选择的仪器是_____。
(2)步骤Ⅲ中滴加的指示剂为_____。滴定达到终点的实验现象是____。
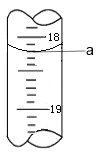
(3)步骤Ⅲ中a 的读数如图所示,则:
① a=_____。
② Cr2O72-的含量为____gL-1。
(4)以下操作会造成废水中Cr2O72-含量测定值偏高的是_____。
A. 滴定终点读数时,俯视滴定管的刻度
B. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 量取Na2S2O3溶液的滴定管用蒸馏水洗后未用标准液润洗
【答案】 酸式滴定管 淀粉溶液 溶液刚好从蓝色变为无色,且30s内不变色 18.20 2.16 CD
【解析】根据实验目的,含有一定量的Cr2O72-工业废水,
步骤I:取30.00 mL废水,加入适量稀硫酸酸化,提供酸性环境;
步骤Ⅱ:因为Cr2O72-具有氧化性,加入过量的碘化钾溶液,把Cr2O72-还原成三价铬,而碘离子被氧化成碘单质;
步骤III:用0.1000 molL-1Na2S2O3溶液滴定生成的碘单质,通过消耗的Na2S2O3溶液量来计算碘单质的量,再根据碘单质的量回头计算Cr2O72-的量,从而达到实验目的。
详解:(1)根据信息,Cr2O72-氧化性较强,量取废水应用酸式滴定管,因此,本题正确答案是:酸式滴定管;
(2)滴定碘单质应选用淀粉溶液作指示剂;滴定达到终点时碘单质刚好被消耗,所以溶液的颜色由蓝色变为无色,且在半分钟内不变色,
因此,本题正确答案是:淀粉溶液;溶液由蓝色变为无色,且在半分钟内不变色;
(3)① 根据图示,滴定管“0”刻度在上,且精确到0.01mL,a值为18.20;
②从表格数据可知,三次实验消耗0.1000 molL-1Na2S2O3标准溶液的体积平均值为18.00mL,
根据Cr2O72-+6I-+14H+ === 2Cr3++3I2+7H2O和I2+2Na2S2O3 === 2NaI+Na2S4O6
Cr2O72-~3I2~6Na2S2O3,
n(Cr2O72-)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() 0.1000mol/L×18.00×10-3L=3×10-4mol
0.1000mol/L×18.00×10-3L=3×10-4mol
Cr2O72-的含量为:![]() = 2.16gL-1
= 2.16gL-1
(4)根据Cr2O72-+6I-+14H+ === 2Cr3++3I2+7H2O和I2+2Na2S2O3 === 2NaI+Na2S4O6,
则c(待测)偏高,Cr2O72-含量就偏高;
A.滴定终点读数时,俯视滴定管的刻度,造成V(标准)偏小,根据c(待测)=![]() 分析,测定c(待测)偏低,故A错误;
分析,测定c(待测)偏低,故A错误;
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗,对V(标准)无影响,根据c(待测)=![]() 分析,测定c(待测)无影响,故B错误;
分析,测定c(待测)无影响,故B错误;
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(标准)偏大,根据c(待测)=![]() 分析,测定c(待测)偏高,所以C选项是正确的;
分析,测定c(待测)偏高,所以C选项是正确的;
D.未用标准液润洗碱式滴定管,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)![]() 分析,测定c(待测)偏高,所以D选项是正确的;
分析,测定c(待测)偏高,所以D选项是正确的;
因此,本题正确答案是:CD。

【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 在0.1 molL-1Na2CO3溶液中,滴加2滴酚酞显浅红色,微热,红色加深 | CO32-水解是吸热反应 |
B | 等体积、pH=3的两种酸HA和HB分别与足量的Zn反应,酸HA放出的氢气多 | 酸性A比B强 |
C | 常温下,用饱和Na2CO3溶液可将BaSO4部分转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
D | 室温下,用pH试纸测得:0.1 molL-1 Na2SO3溶液的pH约为10;0.1 molL-1 NaHSO3溶液的pH约为5 | HSO |
A. A B. B C. C D. D
【题目】工业上用粗制的氧化铜粉末(含杂质Fe和SiO2)来制取无水CuCl2的工艺流程如图所示:
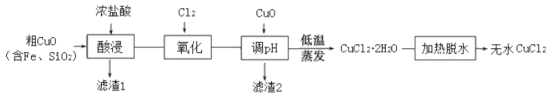
(1)“酸浸”时发生的复分解反应化学方程式为:____。为加快酸浸速率可以采取的措施是:____(任举一条)。
(2)“氧化”时发生的离子方程式为:_____。
(3)下表列出了相关金属离子生成氢氧化物沉淀的pH。“调pH”时应控制溶液pH范围为_____。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1. 5 | 3. 7 |
Cu2+ | 4.2 | 6. 4 |
Fe2+ | 6.5 | 9.7 |
当pH=4时,溶液中c(Fe3+)=____。已知:Ksp[Fe(OH)3]=2.6×10―39
(4)“加热脱水”需要提供的条件为:_____。
【题目】用下图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
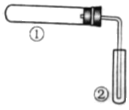
①中实验 | ②中现象 | |
A | 铁粉与水蒸气加热 | 肥皂水冒泡 |
B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
C | NaHCO3固体受热分解 | 澄清石灰水变浑浊 |
D | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |