题目内容
在100mL 12mol/L的浓盐酸中加入足量的MnO2加热,充分反应后得到Cl2的物质的量是(不考虑Cl2在反应过程中的任何损失)( )
| A、0.6 mol |
| B、在0.3~0.6 mol之间 |
| C、0.3 mol |
| D、小于0.3 mol |
考点:化学方程式的有关计算
专题:
分析:发生反应:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,假设HCl完全反应,计算生成氯气的物质的量,由于随反应进行,浓盐酸变为稀盐酸,而二氧化锰不与稀盐酸反应,故生成氯气的物质的量需要极限假设值.
| ||
解答:
解:HCl的物质的量为0.1L×12mol/L=1.2mol,假设HCl完全反应,由方程式MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,可知生成氯气的物质的量为1.2mol×
=0.3mol,由于随反应进行,浓盐酸变为稀盐酸,而二氧化锰不与稀盐酸反应,故生成氯气的物质的量小于0.3mol,
故选D.
| ||
| 1 |
| 4 |
故选D.
点评:本题考查化学方程式的有关计算,难度不大,关键是明确二氧化锰与浓盐酸反应,与稀盐酸不反应.

练习册系列答案
相关题目
 有媒体报道一种新型污水处理装置问世,该装置可利用一种微生物将有机废水的化学能直接转化为电能,该装置的构造如图所示.下列说法中正确的是( )
有媒体报道一种新型污水处理装置问世,该装置可利用一种微生物将有机废水的化学能直接转化为电能,该装置的构造如图所示.下列说法中正确的是( )| A、装置外电路中箭头的方向代表电流的方向 |
| B、该装置为原电池装置,其中N为负极 |
| C、若有机废水中含有葡萄糖,则M电极发生的电极反应式为C6H12O6+6H2O-24e-═6CO2+24H+ |
| D、该处理工艺会导致有机废水酸性增强,仍旧不能直接排放 |
短周期元素W、X、Y、Z 的原子序数依次增大,W与Y,X与Z 位于同一主族.W 与X 可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5 倍.下列叙述中不正确的是( )
| A、X的氢化物是同主族元素氢化物中沸点最高,稳定性最好的 |
| B、WX2,YX2的化学键类型和立体构型都相同 |
| C、WX2是以极性键结合成的非极性分子 |
| D、W、Y、Z元素形成的最高价含氧酸的酸性由弱到强为Y<W<Z |
下列说法正确的是( )
| A、把100 mL 3 mol/L的H2SO4跟100 mL 水混合,硫酸的物质的量浓度变为1.5 mol/L |
| B、把200 mL 3 mol/L的BaCl2溶液跟100 mL 3 mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol/L |
| C、把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% |
| D、把100 mL 1 mol/L的NaOH溶液取出10 mL后,NaOH溶液的浓度减小 |
下列变化过程中,不涉及化学变化的是( )
| A、氯化钠的熔化 |
| B、碳的燃烧 |
| C、氨气溶于水 |
| D、水的通电分解 |
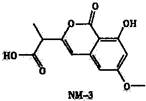 M-3是种正处于临床试验阶段的小分子抗癌药物,其结构如图所示(未表示出其空间构型).下列关于NM-3的性质描述正确的是( )
M-3是种正处于临床试验阶段的小分子抗癌药物,其结构如图所示(未表示出其空间构型).下列关于NM-3的性质描述正确的是( )| A、不含有手性碳原子 |
| B、能使溴的四氯化碳溶液褪色 |
| C、能与FeC13溶液发生显色反应 |
| D、1mo1该物质最多可与2mo1NaOH反应 |