题目内容
5.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,X与Z可形成常见的XZ或XZ2型分子,Y与M形成的气态化合物质量是相同条件下同体积氢气的8.5倍,W是原子半径最大的短周期元素.下列判断正确的是( )| A. | 最高价含氧酸酸性:X<Y | B. | X、Y、Z可形成离子化合物 | ||
| C. | W可形成双原子分子 | D. | M与W形成的化合物含极性共价键 |
分析 X、Y、Z、M、W为五种短周期元素.Y与M形成的气态化合物质量是相同条件下同体积氢气的8.5倍,该气体相对分子质量为8.5×2=17,应为NH3,而X、Y、Z是原子序数依次递增的同周期元素,只能处于第二周期,故Y为N元素、M为H元素;X与Z可形成常见的XZ或XZ2型分子,则X为C元素、Z为O元素;W是原子半径最大的短周期元素,则W为Na,据此解答.
解答 解:X、Y、Z、M、W为五种短周期元素.Y与M形成的气态化合物质量是相同条件下同体积氢气的8.5倍,该气体相对分子质量为8.5×2=17,应为NH3,而X、Y、Z是原子序数依次递增的同周期元素,只能处于第二周期,故Y为N元素、M为H元素;X与Z可形成常见的XZ或XZ2型分子,则X为C元素、Z为O元素;W是原子半径最大的短周期元素,则W为Na.
A.非金属性X(C)<Y(N),故最高价含氧酸酸性:碳酸<硝酸,故A正确;
B.C、N、O可形成共价化合物,不能形成离子化合物,故B错误;
C.W为Na,为金属元素,不能形成双原子分子,故C错误;
D.M与W形成的化合物为NaH,含有离子键,故D错误,
故选A.
点评 本题考查结构性质位置关系综合应用,推断元素是解题关键,注意D选项中金属氢化物.

练习册系列答案
相关题目
16.下列药品和装置合理且能完成相应实验的是( )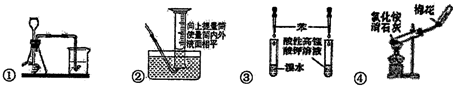

| A. | ①检查装置气密性 | B. | ②读取气体体积 | ||
| C. | ③验证苯中是否有碳碳双键 | D. | ④实验室制取并收集氨气 |
13. 是制作电木的原料.下列围绕此物质的讨论正确的是( )
是制作电木的原料.下列围绕此物质的讨论正确的是( )
 是制作电木的原料.下列围绕此物质的讨论正确的是( )
是制作电木的原料.下列围绕此物质的讨论正确的是( )| A. | 该有机物没有确定的熔点 | B. | 该有机物通过加聚反应得到 | ||
| C. | 该有机物通过苯酚和甲醇反应得到 | D. | 该有机物的单体是-C6H3OHCH2- |
20.以下实验原理或操作中正确的是( )
| A. | 焰色反应实验中,铂丝在蘸取待测溶液前,应先用稀H2SO4洗净并灼烧 | |
| B. | 制备氢氧化铜悬浊液时,向10%NaOH溶液中滴入少量2%CuSO4溶液 | |
| C. | 配制浓H2SO4、浓HNO3混合酸时,首先向试管里放入一定量浓H2SO4 | |
| D. | 纸层析实验中,将试液点滴浸没在展开剂里,静置观察 |
17.下列实验过程中,始终看不到明显变化的是( )
| A. | 向l0mL0.1mol•L-1FeI,溶液中缓缓通人标准状况下11.2mL Cl2 | |
| B. | 向AlCl3溶液中滴加Na2S溶液 | |
| C. | 向含有Na+、Fe2+、Cl-、SO42-离子的溶液中通入NO2 | |
| D. | 向5mL0.1 mol•L-1NaOH溶液中,逐滴加入1 mL0.1 mol•L-1AlCl3溶液,边滴加边振荡 |
14. 体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )
体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )
 体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )
体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )| A. | 曲线a是500℃时的图象 | |
| B. | 从0到t1时刻,反应物X(g)的$\frac{v(300℃)}{v(500℃)}$>1 | |
| C. | t2时刻生成物Z的量$\frac{{△v}_{1}(300℃)}{{△v}_{1}(500℃)}$ | |
| D. | t3时刻改变的条件可能是降温 |
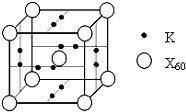 已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题:
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题:
 .
. (其中一种).
(其中一种). )的合成路线.
)的合成路线.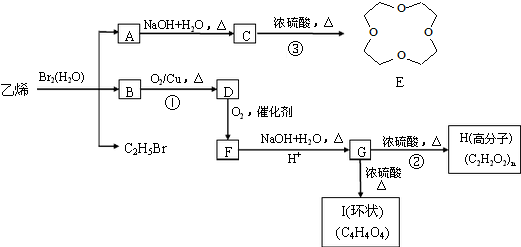
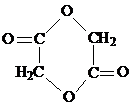 .
.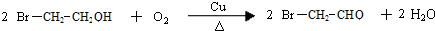 .写出反应 ②的化学方程式
.写出反应 ②的化学方程式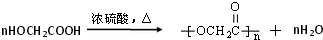 .
.