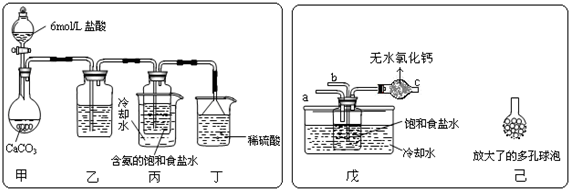
题目内容
15.“低碳”既是时尚,也是环保要求.“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂联合生产等都是很好的“低碳”生产方式.如图是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺: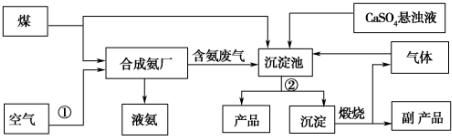
请回答下列问题:
(1)工艺操作①②分别为液化、过滤.
(2)工业合成氨的化学方程式为N2+3H2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
(3)写出生成“产品”的离子方程式:CaSO4+2NH3+CO2+H2O=CaCO3↓+2NH4++SO42-.
(4)检验合成氨厂废气中是否含有氨气的方法是用湿润的红色石蕊试纸放在管口处,若试纸变蓝,证明废气中有NH3
(5)副产品的化学式为CaO.该联合生产工艺中可以循环使用的物质是CO2.
分析 煤和水蒸气反应生成氢气,利用空气中氮气和氢气在高温高压催化剂作用下反应生成氨气镁燃烧生成的二氧化碳、生成的氨气和硫酸钙仪器进入沉淀池中发生反应生成碳酸钙沉淀和产品,碳酸钙煅烧得到副产品氧化钙,生成的二氧化碳进入沉淀池循环使用
(1)操作①是将空气液化后蒸馏分离出氧气,获得氮气;操作②为分离固体与溶液;
(2)工业合成氨是高温高压催化剂条件下反应生成氨气;
(3)“产品”为(NH4)2SO4,反应物为CaSO4悬浊液、CO2、NH3等,产物除(NH4)2SO4外还有CaCO3,据此写出反应的离子方程式;
(4)通常用湿润的红色石蕊试纸检验NH3;
(5)煅烧碳酸钙后可生成二氧化碳和氧化钙,氧化钙为副产品,二氧化碳可循环利用.
解答 解:(1)合成氨原料之一氮气来源于空气,分离方法是将空气液化后蒸发分离出O2获得N2,所以操作①为液化;将沉淀池中的混合物经过滤可得到产品和沉淀,则操作②为过滤,
故答案为:液化;过滤;
(2)工业合成氨的化学方程式为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,故答案为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;
(3)“产品”是(NH4)2SO4,反应物是CaSO4悬浊液、CO2、NH3等,产物除(NH4)2SO4外还有CaCO3,其中离子方程中CaSO4悬浊液要写分子式,反应化学方程式为:CaSO4+CO2+2NH3+H2O═CaCO3↓+(NH4)2SO4,改写成离子方程式为:CaSO4+2NH3+CO2+H2O=CaCO3↓+2NH4++SO42-,
故答案为:CaSO4+2NH3+CO2+H2O=CaCO3↓+2NH4++SO42-;
(4)利用湿润的红色石蕊试纸检验NH3,操作方法为:用湿润的红色石蕊试纸放在管口处,若试纸变蓝,证明废气中有NH3,
故答案为:用湿润的红色石蕊试纸放在管口处,若试纸变蓝,证明废气中有NH3;
(5)CaCO3煅烧可生成CO2和CaO,其中CO2可循环使用,CaO为副产品,
故答案为:CaO;CO2.
点评 本题考查了物质制备方案的设计,题目难度中等,明确制备流程及发生反应原理为解答关键,注意掌握化学实验基本操作方法,试题侧重考查学生的分析能力及化学实验能力.

 名校课堂系列答案
名校课堂系列答案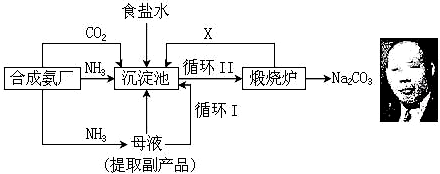
①工业合成氨时,通常采用以铁为主的催化剂,在温度为℃和压强为400~500、10~30MPa的条件下合成.
②沉淀池中发生反应的化学方程式NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓.
③上述流程中可循环利用的物质为NH3、CO2(填化学式),副产品为NH4Cl(填化学式).
④与氨碱法生产纯碱比较,侯氏制碱法有什么优点?综合利用原料(氯化钠的利用率提高到了96%)、降低成本、减少环境污染.
(2)实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体.
四种盐在不同温度下的溶解度(g/100g水)表
温度 盐 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
为控制此温度范围,通常采取的加热方法为水浴加热.
⑥保温30分钟,静置后只析出NaHCO3晶体的原因相同温度下,碳酸氢钠的溶解度小.
| 氨碱法 | 联合制碱法 | ||
| A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B. | 副产物 | 氯化钙 | 氯化铵 |
| C. | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
| D. | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |
| A. | A | B. | B | C. | C | D. | D |
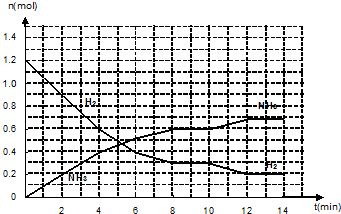
| A. | 乙中的热化学方程式为2C(g)?A(g)+3B(g);△H=+4Q2/3kJ/mol | |
| B. | 反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正大于v逆 | |
| C. | 在该条件下,反应2C(g)?A(g)+3B(g)的平衡常数为9×1.52(mol/L)2 | |
| D. | 乙中C的转化率为25% |
| A. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4↓ | |
| D. | 将氢氧化铁放入盐酸中:Fe(OH)3+3H+=Fe3++3H2O |
| A. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| B. | 蒸馏操作时,应将温度计插入蒸馏烧瓶内混合溶液中 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
 氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.