题目内容
1.下列有关实验装置进行的相应实验,能达到实验目的是( )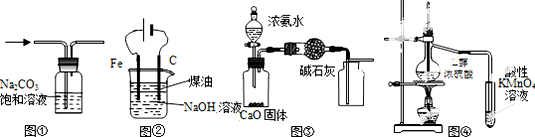
| A. | 图①除去CO2中的HCl | |
| B. | 图②装置制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | 图③所示装置制取并收集干燥纯净的NH3 | |
| D. | 图④证明CH3CH2OH发生消去反应生成了乙烯 |
分析 A.二氧化碳和氯化氢都能与碳酸钠反应;
B.铁为阳极,被氧化生成Fe2+;
C.氨气密度比空气小,应用向下排空法收集;
D.乙醇能使酸性高锰酸钾褪色.
解答 解:A.二氧化碳和氯化氢都能与碳酸钠反应,将原物质除掉,故A错误;
B.铁为阳极,被氧化生成Fe2+,进而生成Fe(OH)2,故B正确;
C.气体收集错误,氨气密度比空气小,应用向下排空法收集,故C错误;
D.乙醇能使酸性高锰酸钾褪色,应先除掉乙醇,故D错误.
故选B.
点评 本题考查较为综合,涉及物质的分离、制备以及气体的检验等知识,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同以及实验的严密性、可行性的评价,难度中等.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | 凡是中心原子采取sp3杂化的分子,其立体构型都是正四面体型 | |
| B. | 在SCl2中,中心原子S采取sp杂化轨道成键 | |
| C. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| D. | 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
12.如图所示的实验操作中,不正确的是( )
| A. |  检查容量瓶是否漏水 | B. |  给溶液加热 | ||
| C. |  滴加液体 | D. |  过滤 |
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA | |
| B. | 4.2 g C3H6中含有的碳碳双键数一定为0.1 NA | |
| C. | 1 mol-OH中电子数为10 NA | |
| D. | 标准状况下,2.24 L CHCl3的原子总数为0.1 NA |
10.下列区分物质的方法不正确的是( )
| A. | 用澄清石灰水区别SO2和CO2 | |
| B. | 用酸性KMnO4溶液区分苯和乙烯 | |
| C. | 用新制Cu(OH)2悬浊液区分蔗糖和葡萄糖 | |
| D. | 用加热的方式区别碳酸钠和碳酸氢钠 |
11.能说明CH3COOH是弱电解质的事实是( )
| A. | 常温下,0.1 mol•L-1 CH3COOH溶液的pH=3 | |
| B. | CH3COOH溶液能和NaOH溶液反应 | |
| C. | 往CH3COOH溶液中加入几滴石蕊试液,溶液变红色 | |
| D. | 0.1 mol•L-1CH3COOH溶液做导电性实验,灯光较暗 |
 .
.