题目内容
19.在恒容密闭容器中发生反应2SO2+O2?2SO3,当其他条件不变时,只改变一个条件,不能加快化学反应速率的是( )| A. | 增加SO2的浓度 | B. | 充入一定量惰性气体 | ||
| C. | 升高温度 | D. | 使用催化剂 |
分析 该反应是一个反应前后气体体积减小的可逆反应,增大浓度、升高温度、加入催化剂、增大压强等都增大反应速率,据此分析解答.
解答 解:A.增加二氧化硫的浓度,增大单位体积内活化分子个数,所以反应速率增大,故A不选;
B.充入惰性气体,反应物浓度不变,则反应速率不变,故B选;
C.升高温度,增大活化分子百分数,所以反应速率增大,故C不选;
D.使用催化剂,增大活化分子百分数,所以反应速率增大,故D不选;
故选B.
点评 本题考查化学反应速率影响因素,明确化学反应速率影响原理是解本题关键,易错选项是B,充入惰性气体虽然压强增大,但反应物浓度不变,为易错点.

练习册系列答案
相关题目
15.下列装置或操作能达到实验目的是( )
| A. | 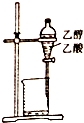 除去乙醇中的乙酸 | B. | 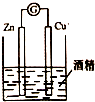 形成原电池 | ||
| C. | 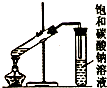 制取乙酸乙酯 | D. | 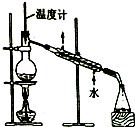 石油的蒸馏 |
10.下列溶液一定显酸性的是( )
| A. | [H+]=[OH-]的溶液 | B. | pH<7的溶液 | ||
| C. | [H+]=1.0×10-7mol•L-1 的溶液 | D. | [H+]>[OH-]的溶液 |
7.NA代表阿伏伽德罗常数,下列说法不正确的是( )
| A. | 10gD2O中含有的电子数为5NA | |
| B. | 1molC3H8分子中共价键总数为10NA | |
| C. | 92gNO2和N2O4混合气体中含有原子数为3NA | |
| D. | 65gZn全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为2NA |
14.下列既含离子键又含有极性键的物质是( )
| A. | NaCl | B. | NaOH | C. | H2 | D. | HCl |
4.NA代表阿伏加德罗常数,下列说法不正确的是( )
| A. | 10g D2O中含有的电子数为5 NA | |
| B. | 1mol C3H8分子中共价键总数为10 NA | |
| C. | 92g NO2和N2O4混合气体中含有原子数为3 NA | |
| D. | 65gZn全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为2NA |
9.如表中评价合理的是( )
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | 铁与稀盐酸反应: 2Fe+6H+═2Fe3++3H2↑ | 正确 |
| B | 大理石溶于醋酸的反应: CaCO3+2H+═Ca2++CO2↑+H2O | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
| C | FeCl3溶液“腐蚀”铜箔: Fe3++Cu═Fe2++Cu2+ | 正确 |
| D | NH4HCO3溶液与过量NaOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | 错误,HCO3-也可以与OH-反应 |
| A. | A | B. | B | C. | C | D. | D |
 .
. .
.