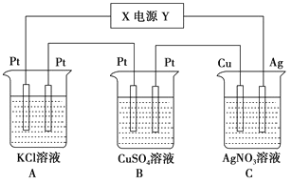
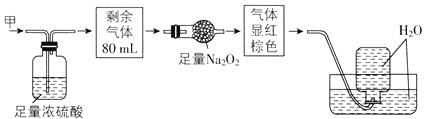
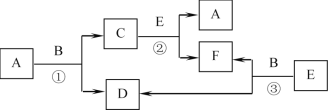
��Ŀ����
����Ŀ��2SO2(g)+O2(g)![]() 2SO3(g)��Ӧ���̵������仯��ͼ��ʾ����ش��������⣺
2SO3(g)��Ӧ���̵������仯��ͼ��ʾ����ش��������⣺
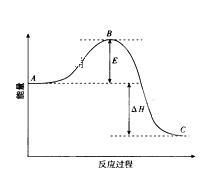
(1)�÷�Ӧͨ����V2O5�������ӿ췴Ӧ�Ľ��У���V2O5��ʹͼ��B��______������ߡ����͡�����
(2)E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ������Ӱ��_______��
(3)ͼ��A��ʾSO2(g)��O2(g)��_________��
(4)ͼ�С�H��������__________��
(5)V2O5�Ĵ�ѭ����������Ϊ��V2O5����SO2ʱ����������ԭΪ�ļ۷�������ļ۷��������ٱ�����������д���ô�����ʵ�ʷ�����Ӧ�Ļ�ѧ����ʽ_____,_____��
(6)�����Ӧ��������SO2��Ϊ0.05 mol��L-1��min-1��������O2��=________��
���𰸡����� ��Ӱ�� ������ 2molSO2(g)�� 1molO2��ȫ��Ӧ����2molSO3(g)ʱ����Ӧ�ų������� V2O5+ SO2=SO3+2VO2 4VO2+O2=2V2O5 0.025 mol��L-1��min-1
��������
(1)�÷�ӦΪ���ȷ�Ӧ����Ӧ������������������������������AΪ��Ӧ��������CΪ�������������÷�Ӧͨ����V2O5�������ӿ췴Ӧ�Ľ��У���V2O5�ɸı䷴Ӧ�����̣����ͻ�ܣ�ͼ��B��ή�ͣ�
(2)��Ӧ�ȡ�H=����Ӧ���-�淴Ӧ��ܣ���H�Ǹ���ֵ�����E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ����Ӱ�죻
(3)ͼ��A��ʾSO2(g)��O2(g)����������CΪSO3(g)��������
(4)��Ӧ�ȡ�H������2molSO2(g)��1molO2(g)��ȫ��Ӧ����2molSO3(g)ʱ����Ӧ�ų���������
(5)���������Ϣ��֪��V2O5+ SO2=SO3+2VO2��4VO2+O2=2V2O5��
(6)���ݻ�ѧ����ʽ��2SO2(g)+O2(g) =2SO3(g)�������Ӧ����v(SO2)Ϊ0.05 mol��L-1��min-1����������֮�ȵ��ڻ�ѧ������֮�ȿɼ����v(O2)=![]() v(SO2)=0.025mol��L-1��min-1��
v(SO2)=0.025mol��L-1��min-1��

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�����Ŀ����һ���¶��£�������X������Y��2 mol����ij10 L�����ܱ������У�������ӦX(g)+Y(g) ![]() 2Z(g) ��H<0������ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
2Z(g) ��H<0������ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 10 | 12 |
n(Y)/mol | 1.40 | 1.10 | 0.40 | 0.40 |
����˵����ȷ����
A. ��Ӧǰ2 min ��ƽ������v(Z)=3.0xl0-2 mol L-1min-1
B. ���¶��´˷�Ӧ��ƽ�ⳣ��K=64
C. ƽ��������������䣬�ٳ���2 mol Z����ƽ��ʱX�������������
D. ��Ӧ���е�10 minʱ���������������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv(��)>v(����