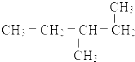题目内容
10.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )| A. | 1mol乙烷中共价键总数为6NA | |
| B. | 1mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.1mol丙烯酸中含有双键的数目为0.2NA | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
分析 A.根据乙烷分子的物质的量及结构计算出含有的共价键数目;
B.1mol甲基含有9mol电子;
C.1mol丙烯酸中含2mol双键;
D.气体摩尔体积适用与气体.
解答 解:A.1mol乙烷分子中含有1mol碳碳共价键和6mol碳氢共价键,总共含有7mol共价键,1 mol乙烷分子中共价键总数为7NA,故A错误;
B.甲基没有发生电子的转移,1mol甲基含有9mol电子,所含的电子总数为9NA,故B正确;
C.丙烯酸中含碳碳双键和碳氧双键,故1mol丙烯酸中含2mol双键,即0.1mol丙烯酸中含有双键的数目为0.2NA,故C正确;
D.标准状况下,苯的状态不是气体,不能使用标况下的气体摩尔体积计算苯的物质的量,故D错误;
故选:BC.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,注意乙烷、丙烯酸的结构,题目难度不大.

练习册系列答案
相关题目
6.一定条件下,可逆反应2X(g)+3Y(g)?4Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.2mol•L-1、0.3mol•L-1、0.16mol•L-1,则下列判断不合理的是( )
| A. | 平衡时,Y和Z的生成速率之比为3:4 | |
| B. | c1的取值范围为0<c1<0.28 mol•L-1 | |
| C. | 当反应达到平衡时,扩大容器的体积,平衡会发生移动 | |
| D. | 此反应,若起始通入2 mol•L-1的X和3 mol•L-1的Y达到平衡时,与起始只通入4 mol•L-1的Z达到平衡时,各物质的组成含量不相同 |
1.常温常压下,向2L密闭容器中加入一定量的A和B气体,发生反应2A(g)+2B(g)?2Q(g)+W(g),△H=M kJ•mol-1,3min后,反应达到平衡,相关数据如下表:则下列说法正确的是( )
| 反应时间/min | n(A)/mol | n(B)/mol |
| 0 | 4 | 4 |
| 0.5 | 3.2 | |
| 2 | 2.4 | |
| 3 | 1.0 |
| A. | 反应在前0.5min时,n(W)=0.6mol | |
| B. | 2min时,反应的平均反应速率为V(Q)=0.48mol/L•s | |
| C. | 相同温度条件下,向平衡后的容器中再充入2mol Q和2mol W时,v(正)>v(逆) | |
| D. | 相同温度下,平衡时的平衡常数为27L•mol-1 |
15.下列说法正确的是( )
| A. | PH3比NH3稳定 | |
| B. | S2-半径比Cl-的小 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na强 | |
| D. | 把钾放入氯化钠的水溶液中可制得金属钠 |
2.下列反应中硝酸既能表现出酸性又表现出氧化性的是( )
| A. | 使石蕊试液变红 | |
| B. | 与铜反应放出NO气体生成Cu(NO3)2和H2O | |
| C. | 与Na2CO3反应放出CO2气体生成NaNO3和H2O | |
| D. | 与S单质混合共热时生成H2SO4和NO2、H2O |
 ⑨235U ⑩
⑨235U ⑩
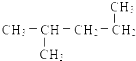 ⑫
⑫