题目内容
16.常温下,将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液,(1)该溶液中存在的三个平衡体系是水解平衡,NH4++H2O?NH3•H2O+H+、电离平衡,H2O?OH-+H+、电离平衡,NH3•H2O?NH4++OH-.
(2)溶液中共有7种不同的粒子,这些粒子中浓度为0.01mol/L的是Cl-,浓度为0.002mol/L的是Na+.
(3)物质的量之和为0.01mol的二种粒子是NH4+、NH3•H2O.
分析 常温下将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L溶液,氯化铵和氢氧化钠反应生成一水合氨和氯化钠,反应的定量关系可知氯化铵过量,溶液中为NH3•H2O、NaCl、NH4Cl溶质,依据化学方程式计算判断溶液中的溶质微粒,结合电荷守恒计算判断问题;
(1)氯化铵和氢氧化钠反应生成一水合氨和氯化钠,氯化铵过量,溶液中存在铵根离子水解平衡,一水合氨形成的化学平衡,水的电离平衡;
(2)钠离子、氯离子在溶液中不发生变化,这些微粒中浓度为0.01mol/L的是Cl-,浓度为0.002mol/L的是Na+;
(3)依据物料守恒分析,氮元素守恒,溶液中氮元素的存在形式为一水合氨和铵根离子,物质的量之和为0.01mol的两种微粒是NH4+、NH3•H2O.
解答 解:常温下将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L溶液,氯化铵和氢氧化钠反应生成一水合氨和氯化钠,氯化铵过量,溶液中为NH3•H2O、NaCl、NH4Cl溶质,
(1)氯化铵和氢氧化钠反应生成一水合氨和氯化钠,氯化铵过量,溶液中存在铵根离子水解平衡,NH4++H2O?NH3•H2O+H+,一水合氨是弱电解质存在电离平衡,NH3•H2O?NH4++OH-,溶液中溶剂水也是弱电解质存在电离平衡,H2O?OH-+H+,该溶液中除H2O的电离平衡外还存在的平衡体系是水解平衡,NH4++H2O?NH3•H2O+H+,一水合氨的电离平衡,NH3•H2O?NH4++OH-,
故答案为:水解平衡,NH4++H2O?NH3•H2O+H+,电离平衡,H2O?OH-+H+,电离平衡,NH3•H2O?NH4++OH-;
(2)这些微粒中,铵根离子水解,一水合氨发生电离,改变了溶液中铵根离子浓度、一水合氨浓度、氢离子浓度和氢氧根离子浓度,而氯离子、钠离子物质的量不变,所以浓度为0.01mol/L的是Cl-,浓度为0.002mol/L的是Na+;
故答案为:Cl-;Na+;
(3)物料守恒分析,0.01mol NH4Cl溶于0.002mol NaOH溶于水配成1L溶液,铵根离子结合氢氧根离子生成一水合氨,一水合氨电离书写铵根离子和氢氧根离子,根据物料守恒可知,氮元素的存在形式为NH4+、NH3•H2O,但溶液中存在的氮元素物质的量一定为1mol,则物质的量之和为0.01mol的两种微粒是NH4+、NH3•H2O;
故答案为:NH4+、NH3•H2O.
点评 本题考查了弱电解质电离,盐类水解原理,明确影响平衡移动的因素、电解质溶液中电荷守恒、物料守恒,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 物质燃烧都是放热反应 | |
| B. | 化学反应总是伴随着能量的变化 | |
| C. | 化学反应中需要加热的反应一定是吸收反应 | |
| D. | 化学反应中放出的热量就是反应热 |
| A. | H2S Mn(OH)2 MgCl2 H2O | |
| B. | HF KOH CO Na2CO3 | |
| C. | NH3 Al(OH)3 KBr MgO | |
| D. | H2O NaOH NH4Cl NH3﹒H2O |
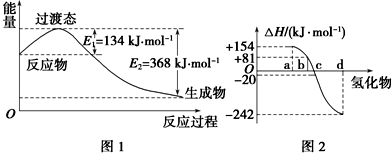
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化,写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)△H=-185kJ•mol-1
请填空:
| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 434 |
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19kJ•mol-1③
请写出CO还原FeO的热化学方程式:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ/mol.
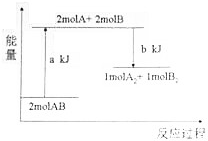
| A. | 该反应是放热反应 | |
| B. | 该反应一定要在加热条件下才能进行 | |
| C. | 断开lmolA2中的化学键和lmolB2中的化学键需吸收akJ的能量 | |
| D. | 1moIA2和1moIB2的总能量高于2molAB的总能量 |
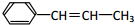 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 能发生加聚反应,其生成物可用 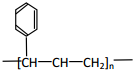 来表示 来表示 | |
| C. | 能使溴水褪色,但不能使酸性高锰酸钾褪色 | |
| D. | 可以发生加成、取代、氧化反应 |
| A. | 电解熔融态的Al2O3、12C转化为14C都属于化学变化 | |
| B. | 胆矾、冰水混合物、四氧化三铁都不是混合物 | |
| C. | 根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸和多元酸 | |
| D. | SiO2、NO2、Al2O3都属于酸性氧化物 |
[滴定时,1mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ称取样品1.500g.
步骤Ⅱ将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ量取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)步骤Ⅱ中除容量瓶还需要烧杯、玻璃棒、胶头滴管玻璃仪器
(2)根据步骤Ⅲ填空:
①量取样品溶液用酸式滴定管(填酸式或碱式)②滴定管用蒸馏水洗涤后,直接量取样品溶液,则测得样品中氮的质量分数偏低(填“偏高”、“偏低”或“无影响”).③装标准液的滴定管在滴定前有气泡,滴定后气泡消失;则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
④滴定达到终点时,现象溶液刚好由无色变为浅红色,且半分钟内不褪色
(3)滴定结果如表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.05 |
| 2 | 25.00 | 2.00 | 22.01 |
| 3 | 25.00 | 0.50 | 21.50 |
| 4 | 25.00 | 0.20 | 20.22 |