题目内容
试回答下列问题:
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为______;
(2)将1molNa和lmol Mg分别投入到过量的盐酸中,分别得到溶液a和b,则溶液a和b的质量大小关系为ma______mb;
(3)下图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19g?cm-3HCl的质量分数:36.5% |
①该浓盐酸中HCl的物质的量浓度为______mol/L;
②标准状况下,1.00L水(密度:1.00g?cm-3)吸收______L的HCl可制得上述浓盐酸.
解:(1)根据质量守恒得C的质量=24gA+40g-32g=32g,M=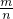 =
= =80g/mol,故答案为:80g/mol;
=80g/mol,故答案为:80g/mol;
(2)1mol钠和足量盐酸反应生成0.5mol氢气,1mol镁和足量盐酸反应生成1mol氢气,
氯化钠溶液中增加的质量=23g/mol×1mol-0.5mol×2g/mol=22g,
氯化镁溶液中增加的质量=24g/mol×1mol-1mol×2g/mol=22g,所以溶液a和b的质量大小关系为ma=mb,
故答案为:=;
(3)①C= =
= =11.9mol/L,故答案为:11.9;
=11.9mol/L,故答案为:11.9;
②设HCl的体积为VL,标况下,氯气的质量= g,水的质量=1000mL×1.00g?cm-3=1000g,
g,水的质量=1000mL×1.00g?cm-3=1000g,
其质量分数= =36.5%,V=353,
=36.5%,V=353,
故答案为:353.
分析:(1)根据质量守恒计算生成C的质量,再根据M=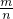 计算其摩尔质量;
计算其摩尔质量;
(2)钠溶于盐酸后,溶液增加的质量=钠的质量-氢气的质量,镁溶于盐酸后,溶液增加的质量=镁的质量-氢气的质量;
(3)①C= ;
;
②先设氯化氢的体积,根据氯化氢的体积计算其质量,再根据质量发生公式计算氯化氢的体积;
点评:本题考查了物质的量浓度的有关计算,注意物质的量浓度公式中,体积为溶液的体积不是溶剂的体积,为易错点.
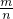 =
= =80g/mol,故答案为:80g/mol;
=80g/mol,故答案为:80g/mol;(2)1mol钠和足量盐酸反应生成0.5mol氢气,1mol镁和足量盐酸反应生成1mol氢气,
氯化钠溶液中增加的质量=23g/mol×1mol-0.5mol×2g/mol=22g,
氯化镁溶液中增加的质量=24g/mol×1mol-1mol×2g/mol=22g,所以溶液a和b的质量大小关系为ma=mb,
故答案为:=;
(3)①C=
 =
= =11.9mol/L,故答案为:11.9;
=11.9mol/L,故答案为:11.9;②设HCl的体积为VL,标况下,氯气的质量=
 g,水的质量=1000mL×1.00g?cm-3=1000g,
g,水的质量=1000mL×1.00g?cm-3=1000g,其质量分数=
 =36.5%,V=353,
=36.5%,V=353,故答案为:353.
分析:(1)根据质量守恒计算生成C的质量,再根据M=
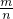 计算其摩尔质量;
计算其摩尔质量;(2)钠溶于盐酸后,溶液增加的质量=钠的质量-氢气的质量,镁溶于盐酸后,溶液增加的质量=镁的质量-氢气的质量;
(3)①C=
 ;
;②先设氯化氢的体积,根据氯化氢的体积计算其质量,再根据质量发生公式计算氯化氢的体积;
点评:本题考查了物质的量浓度的有关计算,注意物质的量浓度公式中,体积为溶液的体积不是溶剂的体积,为易错点.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目











 、
、


 已知可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路).进行如下操作:
已知可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路).进行如下操作: