题目内容
下图是NaCl、MgSO4的溶解度曲线。下列说法正确的是( )。
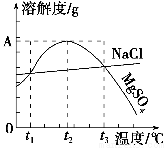
A.只有在t1℃时,NaCl和MgSO4的溶解度才相等
B.t1℃~t2℃,MgSO4的溶解度随温度升高而减小
C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,溶液的物质的量浓度减小
C
【解析】 A项,t1℃、t3℃时,NaCl、MgSO4的溶解度相等;B项,t2之前,MgSO4的溶解度随温度的升高而增大,t2之后,随温度的升高而降低;C项,w= ×100%,S越大,w越大;D项,把MgSO4饱和溶液的温度从t3℃降至t2℃时,由饱和溶液变成不饱和溶液,不会有晶体析出,溶液的物质的量浓度不变。
×100%,S越大,w越大;D项,把MgSO4饱和溶液的温度从t3℃降至t2℃时,由饱和溶液变成不饱和溶液,不会有晶体析出,溶液的物质的量浓度不变。

某同学为了验证Fe3+是否能氧化H2SO3生成SO,他用50 mL 0.1 mol·L-1 FeCl3溶液吸收制取SO2气体的尾气后,进行以下实验:
(1)检验吸收液中的SO42—:_____________________________,
证明Fe3+能够把H2SO3氧化成SO42—。
(2)请完成并配平上述反应中的化学方程式:
2FeCl3+SO2+________===________+H2SO4+________,反应中的氧化产物是________(写化学式)。
(3)吸收液中除了含有H+、Cl-、SO42—以外,对其他成分(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在________。
②设计方案,进行实验,验证假设。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:试管、滴管、0.1 mol·L-1KMnO4溶液、0.1 mol·L-1KSCN溶液、品红稀溶液。
实验步骤 | 预期现象和结论 |
步骤1:用试管取样品溶液2~3 mL,再用滴管取_________ | 若出现红色,则假设1成立;若未出现红色,则假设1不成立(或假设2成立) |
步骤2: |
|
步骤3: |
|







