题目内容
已知CO和Fe2O3在高温下发生反应:3CO + Fe2O3 2Fe + 3CO2 ,其中Fe2O3被_____________(填“氧化”或“还原”),具有 ______ 性。在该反应中,若生成了1 mol Fe,则转移了_______mol e- 。
2Fe + 3CO2 ,其中Fe2O3被_____________(填“氧化”或“还原”),具有 ______ 性。在该反应中,若生成了1 mol Fe,则转移了_______mol e- 。
 2Fe + 3CO2 ,其中Fe2O3被_____________(填“氧化”或“还原”),具有 ______ 性。在该反应中,若生成了1 mol Fe,则转移了_______mol e- 。
2Fe + 3CO2 ,其中Fe2O3被_____________(填“氧化”或“还原”),具有 ______ 性。在该反应中,若生成了1 mol Fe,则转移了_______mol e- 。 还原;氧化;3

练习册系列答案
相关题目
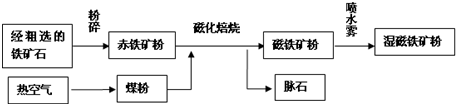
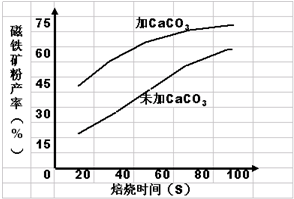
 2Fe+3CO2,其中Fe2O3被____________(填“氧化”或“还原”),具有______ 性。在该反应中,若生成了1molFe,则转移了_______mol e-。
2Fe+3CO2,其中Fe2O3被____________(填“氧化”或“还原”),具有______ 性。在该反应中,若生成了1molFe,则转移了_______mol e-。