题目内容
| |||||||||||||||||||||||||||||
解析:
(1) |
答案:a,b,d,c 解析:(1)观察电离平衡常数可知酸性为CH3COOH>H2CO3>HClO>HCO3-,而这些酸失去氢离子后水解能力却正好相反,所以得出PH大小顺序为a,b,d,c |
(3) |
答案:大于 稀释相同倍数,HX的PH变化比CH3COOH大,酸性强,电离平衡常数大;大于 HX酸性强于CH3COOH,稀释后c(H+)小于CH3COOH溶液中的c(H+),所以对水的抑制能力减弱. 解析:醋酸是弱电解质,稀释后电离程度增大,但CH3COOH,CH3COO-,H+浓度却都要减小,但c(OH-)却是增大的,且CH3COOH浓度减少最多. |
(4) |
答案:9.9×10-7 mol/L. 解析:根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7 |

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
 (2012?枣庄二模)物质在水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值(25℃):
(2012?枣庄二模)物质在水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值(25℃):
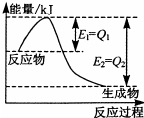 运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.
运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.


