题目内容
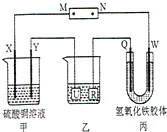
如图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深.下列说法中错误的是( )

| A.电源的M极为正极 |
| B.甲装置中溶液的pH减小 |
| C.甲装置的两个电极上都有单质生成且物质的量之比为1:1 |
| D.欲用乙装置给铜镀银,U极应该是Ag,电镀液选择AgNO3溶液 |

A.氢氧化铁胶粒带正电,通电时,W极附近颜色逐渐加深,说明W连接电源的负极,则M为正极,N为负极,故A正确;
B.通电时,甲中X为阳极,电极反应为2H2O-4e-=O2↑+4H+,Y为阴极,电极反应为2Cu2++4e-=2Cu,总反应为:2CuSO4+2H2O
2Cu+2H2SO4+O2↑,甲装置中溶液的pH减小,故B正确;
C.通电时,甲中X为阳极,电极反应为2H2O-4e-=O2↑+4H+,Y为阴极,电极反应为2Cu2++4e-=2Cu,甲装置的两个电极上都有单质生成且物质的量之比为n(O2):n(Cu)=1:2,故C错误;
D.欲用乙装置给铜镀银,Ag应连接电源的正极,即U极应该是Ag,电镀液为AgNO3溶液,故D正确.
故选C.
B.通电时,甲中X为阳极,电极反应为2H2O-4e-=O2↑+4H+,Y为阴极,电极反应为2Cu2++4e-=2Cu,总反应为:2CuSO4+2H2O
| ||
C.通电时,甲中X为阳极,电极反应为2H2O-4e-=O2↑+4H+,Y为阴极,电极反应为2Cu2++4e-=2Cu,甲装置的两个电极上都有单质生成且物质的量之比为n(O2):n(Cu)=1:2,故C错误;
D.欲用乙装置给铜镀银,Ag应连接电源的正极,即U极应该是Ag,电镀液为AgNO3溶液,故D正确.
故选C.

练习册系列答案
相关题目
W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,Z与M的最低负化合价相同,X、M在周期表中位置如图所示。
| X | ||
| M |
(1)X在周期表中的位置为 ,Q的元素名称为 ;
(2)Z与W形成的4核离子的电子式为 ;
(3)由W、Y、Z、M组成的离子化合物在溶液中相互反应的离子方程式为:
。
(4)W2与Z2反应化合物甲,W2与Q2反应生成化合物乙。已知反应:
乙(g)+Z2(g)→甲(g)+Q2(g),每生成1 mol Q2放热57.8 kJ。写出该反应的热化学方程式:
;
(5)X、Y可分别与Z以原子个数比1∶1形成化合物丙和丁。在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊。写出该反应的化学方程式:
;
(6)将1 mol丙气体和1 mol丁气体充入一装有催化剂的恒压容器中,充分反应达平衡后:
若气体体积较原来减少23%,则丁的转化率为 ;
 (2013?河池模拟)如图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深.下列说法中错误的是( )
(2013?河池模拟)如图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深.下列说法中错误的是( )
